Objectifs :
- Illustrer les effets physiologiques néfastes des métaux lourds sur l’organisme.
- Comprendre les mécanismes de détoxification des métaux lourds dans le corps.
Sommaire :
1- C’est quoi les métaux lourds ? :
Les métaux lourds sont des minéraux sous forme inorganique (métallique) qui sont présents naturellement à l’état de traces dans l’environnement. Ils sont caractérisés par une masse volumique > 5000 kg/m3.On peut citer : arsenic, cadmium, de chrome hexavalent, le cuivre, plomb, mercure, nickel, sélénium, tellure, thallium et l’étain,
Certains métaux sont indispensables à faible quantité (microgramme) comme (le sélénium, le Chrome, le fer) mais L’excès de métaux lourd dans l’organisme provoque une intoxication grave qui peut perturber l’homéostasie cellulaire. Les métaux peuvent perturber les glandes endocrines et la sécrétion des hormones, et ils peuvent inhiber l’action de nos enzymes par compétition avec d’autres sels minéraux indispensables.
L’exposition aux métaux lourds est en train d’augmenter d’une manière spectaculaire avec l’expansion des secteurs industriels, comme les alliages, les aciers inoxydables, les matériaux du bâtiment, les munitions, les matériaux médicaux, la bijouterie…
La combustion de pétrole et de charbon est une source de rejet de métaux lourds dans l’environnement qui contaminent par la suite nos sols agricoles et nos plantes comestibles. De cette manière les métaux peuvent s’infiltrer dans la chaine alimentaire et se retrouver dans nos assiettes.
2- Effet sur le corps et sources d’exposition :
L’impact des métaux lourds sur la santé dépend de plusieurs variables comme la source , la Biodisponibilité et la voie d’exposition.
Les métaux lourds sont hautement toxiques pour les organismes vivants et en particulier l’être humain. Ils s’accumulent dans les tissus et ils ne sont pas biodégradables et persistent dans l’environnement. Selon un article publié dans le journal de scientific world journal les métaux lourd tels que le cadmium , le mercure , et le plomb exercent des effets toxiques sur le système endocrinien , immunitaire et augmentent le risque de plusieurs maladies chroniques [1].
Les symptômes d’une intoxication aiguë aux métaux lourds peuvent varier selon les caractéristiques physiologiques de l’individu , on peut citer :
- Les nausées et les vomissements.
- Douleur abdominale.
- La diarrhée.
- Déshydratation.
- Picotements.
- Anémie.
- Dommages aux reins.
- Dommages au foie.
- Irritation pulmonaire.
- Problèmes de mémoire et de concentration.
- Comportement dépressif.
- Os faibles ou mal formés.
Ci-joint un tableau qui résume l’effet toxique de métaux lourd sur nos organes et la source d’exposition
|
Métal |
Sources |
Effet sur le Corps. |
|
Plomb |
|
|
|
Le mercure |
|
|
|
Le Cadmium |
|
|
|
Arsenic |
|
|
|
Antimoine |
|
|
|
L’étain
|
|
|
|
Le nickel |
|
|
|
Titanium |
|
|
|
Cyanure |
|
|
|
L’or |
|
|
|
Beryllium |
|
|
3- La détoxification des métaux lourds est-elle possible ?
Mécanisme de détoxification moléculaire des métaux lourds :
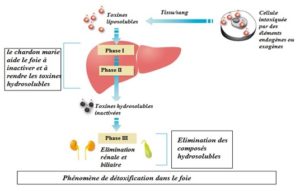
L’élimination des métaux lourds se fait essentiellement par le foie en suivant les réactions de phase 1 et de phase 2.
3-1. Les réactions de phase 1 et de phase 2 dans le foie et le système NRF2 :
Le foie est l’organe responsable de l’élimination des toxines quelque soit d’origine intérieure ( endotoxines bactériennes, ou d’origine extérieure ( métaux lourds).
La détoxification se fait par 3 réactions biochimiques :
La réaction de Phase I : c’est la la réaction de bio transformation qui introduisent des groupements fonctionnels dans les molécules apolaires. Les réactions de la Phase I sont catalysées par les systèmes enzymatiques des cytochromes P450. Lors de la bio transformation, les toxines sont converties en substances intermédiaires, plus actives et plus toxiques, qui doivent être conjuguées au cours de la Phase II.
Au cours de la phase II : les réactions de conjugaison résultent en un transfert de groupements polaires sur la molécule par l’acide glucuronique (glucuronoconjugaison), la glycine (glycuroconjugaison), le sulfate (sulfoconjugaison) le glutathion peroxydase ( GPX) ou d’autres radicaux (méthyl, éthyl , vitamine C…). La glucuronoconjugaison constitue le mécanisme principal : elle est catalysée par des UDP-glucuronyl-transférases (UGT) qui favorise la fixation de l’acide glucuronique sur un atome d’oxygène, d’azote ou de soufre d’une molécule toxique .
Les toxines deviennent alors hydrosolubles éliminable par les émonctoires (urines et sels).
La phase III : les substances hydrosolubles vont passer dans le sang pour être éliminé dans les urines et dans les selles
Notre constitution génétique peut influer énormément notre capacité d’élimination hépatique .
En revanche, l’environnement enzymatique (épigénétique) est modulable en grande partie par notre alimentation et notre capacité d’absorption des micronutriments contenue dans ces aliments : magnésium, zinc, vitamines A, B, C, E, fer, manganèse, cuivre. La richesse en micronutriment de notre assiette, ainsi que la bonne santé de notre intestin et du microbiote, sont des facteurs d’une extrême importance pour le fonctionnement enzymatique de notre foie et pour notre capacité à éliminer les toxines et les métaux lourds .
3-2. L’importance des vitamines A,C,E et sélénium et les protéines :
Pour que les réactions de phase 1 et de phase 2 se déroulent correctement, l’organisme a besoin d’activer les enzymes de phase 1 et 2 . Il a besoin de micronutriments VITAMINES A,C,E et des minéraux sous forme bio disponibles et assimilables.
- Le sélénium :
Cet oligo-élément a de nombreux bienfaits sur l’organisme, il possède un effet antioxydant, permettant de protéger les cellules. Le sélénium active la production de « glutathion-peroxydase » qui est une enzyme favorisant la protection des membranes cellulaires. Associé à la vitamine E, cette enzyme exerce une action protectrice sur l’organisme en protégeant les membranes des radicaux libres. De cette manière, il favorise le ralentissement du vieillissement cellulaire et la détoxification.
- Le glutathion peroxydase :
Le glutathion est une protéine naturellement produite par l’organisme. Il s’agit d’un tripeptide, composé de trois acides aminés : le glutamate (acide glutamique), la cystéine et la glycine. Vous voyez comment une carence en protéines peut contribuer à un déclin dans nos capacités d’élimination des toxines. Le déclin peut être aussi avec l’âge .
Effectivement, à partir de l’âge 45-50 ans commence un déclin du glutathion réduit tandis que le glutathion oxydé augmente. C’est l’âge critique du vieillissement humain, celui où commencent à apparaître les phénomènes de dégénérescence. Le Stress oxydant et vieillissement sont étroitement liés, il est évident qu’un stress oxydatif excessif peut conduire à un vieillissement prématuré.
Le glutathion est un puissant chélateur de métaux lourds [13,14]. Le glutathion joue aussi un rôle majeur dans la défense de l’organisme contre les xénobiotiques (substances étrangères à l’organisme, pollution, médicaments…) et les métaux lourds . Des études ont montré que de faibles niveaux de glutathion engendrent un dysfonctionnement du foie et une augmentation de la quantité de toxines circulant dans l’organisme.
Le glutathion a la capacité de se lier à des toxines comme les métaux lourds, les solvants et les pesticides et de les transformer en composés hydrosolubles qui seront éliminés dans la bile ou les urines. Or cette enzyme ne peut être recyclée que grâce au sélénium !! [15] .
Le glutathion (GSH) est produit d’une façon endogène et certains oligo-éléments peuvent renforcer son rôle protecteur, tels que le zinc, le cuivre, le manganèse, le fer et le sélénium. Le zinc et le cuivre par exemple sont nécessaires pour l’activation de la SOD (superoxyde dismutase) une enzyme antioxydante qui renforce le rôle de glutathion .
- La vitamine C et la détoxification hépatique :
La vitamine C intervient aussi dans la synthèse du glutathion et renforce son rôle protecteur contre les radicaux libres après la survenue d’un stress oxydant [16] . Selon une étude clinique publiée dans le journal de Américan journal of clinical nutrition la prise de 500 mg de vitamine C pendant 3 semaines induit une augmentation de taux de glutathion dans les globules rouges de 50 pourcent dans et la prise de 2000 mg de vitamine C augmente le niveau de glutathion de 85 pourcent [17] .
- Le Système NRF2 :
Le NRF2 est un facteur de transcription qui permet l’activation de nombreux gènes impliqués dans la détoxification cellulaire : la synthèse de glutathion peroxydase, catalase, SOD et l’activation de l’autophagie et le recyclage des protéines dysfonctionnels ,et l’activation de la réparation de l’ADN .
Selon un article publié dans le journal de current chemistry génomics l’exposition aux métaux lourds induit un état de stress oxydant qui active le système NRF2 qui est un facteur de transcription qui joue un rôle clé dans la lutte contre ce stress par l’activation de la synthèse de glutathion [18,19].
- Comment activer le système NRF2 :
Le système NRF2 est activé par plusieurs façons selon les recherches scientifiques :
Selon un article publié dans le journal de Molécular science le jeûne augmente l’expression de NRF2 dans le foie et les muscles squelettiques [20] .
Un article publié dans le journal de Redox biology , l’exercice Physique augmente l’expression de NRf2 [21].
Selon un article publié dans la Review de oxydative médecine and cellular longévity ,une petite exposition au microdoses de molécules extraites à partir des plantes comme : curcumine , sulforaphane , safrol , quercetin , resveratrol , lutein , silymarin active le facteur NRF2 et NQ1 ( une enzyme nécessaire pour la production de NAD+ et l’activation des sirtuines [22].
Faite attention, il y a un mécanisme qui peut avoir un effet négatif sur l’activation du Système NRF2.
C’est La digestion prolongée causée par le grignotage :
Le grignotage : est le « non-stop alimentaire » . Il a été démontré très clairement comment s’installe le mécanisme d’inhibition du complexe migrant interdigestif (C.M.I.) par le grignotage , Cette onde péristaltique qui nettoiera tout le tube digestif des bactéries pathogènes et des métaux lourds . Il faut savoir que chaque être humain naît avec un nombre déterminé de divisions cellulaires au-delà desquelles il meurt. Or la suralimentation et le grignotage sollicitent le tube digestif de manière intensive et exagérée augmentant ainsi le processus de mutation potentiellement cancérigène de l’ADN. Ce processus est la première cause de cancérisation de l’intestin grêle et du côlon. Il est connu que la suralimentation et le régime hypercalorique induit un stress oxydatif au niveau du tube digestif ce qui suractive le système NRF2 conduisant à une déplétion de nos enzymes antioxydantes ( SOD , Catalase , glutathion ) qui au lieu de la détoxification des métaux lourds se focalisent sur la réparation des entérocytes et des colonocytes [23].
Ce phénomène est appelé par les naturopathes le dispatching vital (l’être humain utilise 25 % de son énergie métabolique pour la digestion et 75% pour le pôle neurosensoriel) . Mais c’est beaucoup plus compliqué que ça sur le plan physiologique et biologique. C’est pourquoi que notre système digestif ne peut pas faire un travail digestif prolongé sur toute la journée. C’est pourquoi qu’une diète à l’eau : (le jeune) détoxique mieux qu’une diète à 5 jus de légumes ou de fruits (Un effet prouvé) [24].
LES SIRTUINES : les enzymes clés dans la détoxification des métaux lourds .
Les sirtuines sont une classe d’enzymes, des histones désacétylases NAD-dépendantes, que l’on trouve à la fois chez les procaryotes (dont les bactéries) et les eucaryotes (végétaux et animaux , et être humain ). Elles affectent le métabolisme cellulaire en régulant l’expression de certains gènes par (épigénétique ) .
Les sirtuines sont impliquées dans plusieurs processus biologiques dans la cellule, y compris .
- La production d’énergie.
- La réparation des cellules et de leur ADN, l’autophagie.
- La sensibilité des tissus aux hormones.
- La sécrétion et la sensibilité à l’insuline.
- Le fonctionnement du foie et sa régénération.
- L’adaptation à la restriction calorique.
- La protection contre le processus d’inflammation et d’oxydation.
- La détoxification.
Les sirtuines sont impliqué dans la lutte contre le vieillissement et l’oxydation causé par les radicaux libres. L’activation de l’expression du gène qui code pour les sirtuines est affectée par le niveau de NAD+ (nicotinamide adénine di nucléotide) qui est affecté par plusieurs facteurs :
L’exercice physique et la restriction calorique et le jeune augmentent le niveau de NAD+dans la cellule ce qui augmentent l’expression des sirtuines , aussi des molécules naturelle qui se trouvent dans les plantes telle que ( le resvératrol , la curcumine , l’’acide gallique ) , augmentent l’expression des gènes qui codent pour les sirtuines.
Le sauna permet aussi l’activation des sirtuines . et il a été démontré que le sauna induit une élimination des métaux lourd par voie cutané à travers la sueur [25].
Selon un article publié dans le journal de archives of toxicology . L’intoxication aux métaux lourds ( plomb , mercure , arsenic ) inhibe l’action des sirtuines [26] les mêmes chercheurs ont montré que l’activation des sirtuines protège contre le stress oxydatif induit par l’intoxication au métaux lourds .
Donc activez vos sirtuines pour se désintoxiquer !
4- La chélation des métaux lourds :
Ces méthodes utilisent certains agents chélateurs de métaux lourds comme : le charbon actif et le bentonite qui aident dans la chélation des métaux lourds au niveau de tube digestif.
l’EDTA (ethylenediaminetetraacetic acid) permet la chélation des métaux dans le sang. Les patients intoxiqués par les métaux lourds nécessitent entre 5 et 30 séances d’injection intraveineuse d’EDTA sous le contrôle d’un professionnel de santé . Pour éliminer les métaux lourds d’une manière significative [27].
5- Le drainage hépatique, rénale et digestif par les plantes médicinales :
L’utilisation des plantes médicinales détoxifiantes aide les émonctoires (foie et reins , tube digestif ) dans la phase de détoxification des métaux lourds . Ces plantes peuvent être utilisées en infusion, des parties thérapeutiques (feuilles ou racine, ou graine) .
Remarque : (Consultez un Médecin phytothérapeute qualifié avant d’adopter une cure par les plantes médicinales).
- Les plantes à visé hépatique : (PISSENLIT ( taraxacum officinale ) , CHARDON Marie (Silybum marianum). ARTICHAUT (Cynara cardunculus var. scolymus).
- Les plantes à visé rénale : Gingembre (Zingiber officinale ) , fenouille ( Foeniculum vulgare,) bruyère ( Calluna vulgaris ).
- Les plantes à visé digestives : BARDANE( arctium) , MENTHE POIVRÉE( mentha peperita).
6- Le diagnostic de l’intoxication par les métaux lourds :
La diagnostique de l’intoxication aux métaux lourds se fait selon plusieurs analyses biochimiques qui visent à explorer le bilan sanguin, la fonction hépatique et rénale.
- Bilan hépatique (la transaminase AST, ALT).
- Bilan rénal (créatinine, urée, protéinurie).
- Bilan sanguin (NFS , Hémoglobine , hématocrite).
- Le dosage de 1,25 dihydroxy vitamine D et le PTH : en cas d’intoxication au cadmium par exemple, le niveau de vitamine D baisse et le niveau de PTH ( parathyroïde hormone ) augmente [28].
- Le test d’intoxication à l’arsenic (Chronic Arsenic Intoxication Diagnostic Score(CAsDIS) ) vous permet d’évaluer le niveau d’arsenic dans le corps [29].
Il existe plusieurs tests de dosage de métaux lourds dans les liquides biologique et les tissus : par des kits spécifiques , Ce genre de test permettent :
- Le Dosage des métaux lourds dans le sang.
- Le Dosage des métaux lourds dans les urines.
- Le dosage des métaux lourds dans les cheveux.
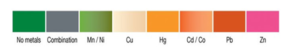
OSUMEX test :
Ce test permet la détection de plusieurs métaux lourds comme : le nickel , le cuivre , le cadmium , le plomb , le zinc , le kit contient :
- 1 Tube à essai avec bouchon blanc spécial.
- 1 flacon contenant la solution de test limpide.
- 1 Pipette/compte-gouttes.
Des bandelettes colorées vous permettent d’identifier l’intoxication par le métal en question. ( la couleur orangé par exemple révèle la présence de plomb dans l’échantillon ).
Les étapes de test d’urine DMPS pour le diagnostic d’intoxication par des métaux lourds :
Ce test se base sur l’utilisation de DMPS qui est un chélateur de métaux lourd qui forme des complexes hydrosolubles avec les métaux lourds suivants par ordre d’affinité décroissante (Zn, Cu, As, Hg, Pb, Sn, Fe, Cd, Ni, Cr). Cet agent est aussi utilisé comme chélateur de chlorure de mercure et il permet de réduire la charge toxique de cet élément dans le corps [30].
Le test DMPS se déroule en suivant ces étapes :
- Le test débute par une injection intraveineuse lente de 250 mg de DMPS (L’acide 2,3-dimercapto-1-propanesulfonique ) qui est administrée à l’aide d’une petite Aiguille pendant plusieurs minutes(ou l’utilisation de gélules orales de DMPS, 250mg x 2, qui peut être pris le dimanche soir et l’urine recueillie jusqu’au matin).
- Vous devez soit éviter d’uriner durant au moins 3 heures.
- Préparez un échantillon d’urine dans le tube à essai fourni (jusqu’à la flèche sur le tube).
- Videz une petite quantité du sac dans le tube à essai d’échantillon fourni dans le kit de test.
Références :
[1] Margaret E. Sears Chelation: Harnessing and Enhancing Heavy Metal Detoxification—A Review world scientific journal
[2] Center for disease control and prevention https://www.cdc.gov/niosh/topics/lead/health.html .
[3] Kevin M Rice 1, Ernest M Walker Jr 2, Miaozong Wu 1, Chris Gillette 3, Eric R Blough 4Environmental mercury and its toxic effects Prev Med Public Health . 2014 Mar;47(2):74-83. doi: 10.3961/jpmph.2014.47.2.74. Epub 2014 Mar 31. Affiliations expand.
[4] Giuseppe Genchi 1, Maria Stefania Sinicropi 1, Graziantonio Lauria 1, Alessia Carocci 2, Alessia Catalano 2
The Effects of Cadmium Toxicity . 2020 May 26;17(11):3782. doi: 10.3390/ijerph17113782. Int J Environ Res Public Health.
[5] Jennifer C Davey 1, Jack E Bodwell, Julie A Gosse, Joshua W Hamilton Affiliations expand Arsenic as an endocrine disruptor: effects of arsenic on estrogen receptor-mediated gene expression in vivo and in cell culture Toxicol Sci . 2007 Jul;98(1):75-86. doi: 10.1093/toxsci/kfm013. Epub 2007 Feb 5.
[6] Shyam Sundar 1, Jaya Chakravarty Antimony toxicity Int J Environ Res Public Health 2010 Dec;7(12):4267-77.
doi: 10.3390/ijerph7124267. Epub 2010 Dec 20. Affiliations expand.
[7] K A Winship Toxicity of tin and its compounds Adverse Drug React Acute Poisoning Rev . Spring 1988;7(1):19-38.
[8] Giuseppe Genchi, Alessia Carocci, […], and Alessia Catalano international journal of environnemental research and public health Nickel: Human Health and Environmental Toxicology.
[9] Kui Liu 1, Xialu Lin, Jinshun ZhaoToxic effects of the interaction of titanium dioxide nanoparticles with chemicals or physical factors Int J Nanomedicine . 2013;8:2509-20. doi: 10.2147/IJN.S46919. Epub 2013 Jul 18.
[10] Huzar TF, George T, Cross JM. Carbon monoxide and cyanide toxicity: etiology, pathophysiology and treatment in inhalation injury. Expert Rev Respir Med. 2013 Apr;7(2):159-70.
[11] Alan B G Lansdown 1 GOLD: human exposure and update on toxic risks Affiliations expand Crit Rev Toxicol. 2018 Aug;48(7):596-614. doi: 10.1080/10408444.2018.1513991.
[12] Ross G. Cooper1,* and Adrian P. Harrison2 The uses and adverse effects of beryllium on health Indian J Occup Environ Med. 2009 Aug; 13(2): 65–76.doi: 10.4103/0019-5278.55122.
[13 ] Marijke Jozefczak, Tony Remans, Jaco Vangronsveld, and Ann Cuypers* Glutathione Is a Key Player in Metal-Induced Oxidative Stress Defenses Int J Mol Sci. 2012; 13(3): 3145–3175.Published online 2012 Mar 7. doi: 10.3390/ijms13033145.
[14 ] Semane B., Cuypers A., Smeets K., van Belleghem F., Horemans N., Schat H., Vangronsveld J. Cadmium responses in Arabidopsis thaliana: Glutathione metabolism and antioxidative defence system. Physiol. Plant. 2007;129:519–528.
[15] G E Arteel 1, H Sies The biochemistry of selenium and the glutathione system Environ Toxicol Pharmacol
. 2001 Sep;10(4):153-8.doi: 10.1016/s1382-6689(01)00078-3.
[16] C S Johnston 1, C G Meyer, J C Srilakshmi Vitamin C elevates red blood cell glutathione in healthy adults Am J
Clin Nutr. 1993 Jul;58(1):103-5. doi: 10.1093/ajcn/58.1.103.
[17] Viviana Montecinos 1, Paula Guzmán, Valeria Barra, Marcelo Villagrán, Carola Muñoz-Montesino, Kirsty Sotomayor, Elizabeth Escobar, Alejandro Godoy, Lorena Mardones, Paula Sotomayor, Catherine Guzmán, Osmán Vásquez, Victoria Gallardo, Brigitte van Zundert, María Rosa Bono, Sergio A Oñate, Marcelo Bustamante, Juan G Cárcamo, Coralia I Rivas, Juan Carlos Vera Vitamin C is an essential antioxidant that enhances survival of oxidatively stressed human vascular endothelial cells in the presence of a vast molar excess of glutathione 2007 May 25;282(21):15506-15. doi: 10.1074/jbc.M608361200. Epub 2007 Apr 2. J Biol Chem.
[18] Steven O Simmons 1, Chun-Yang Fan, Kim Yeoman, John Wakefield, Ram Ramabhadran NRF2 Oxidative Stress Induced by Heavy Metals is Cell Type Dependent Curr Chem Genomics 2011;5:1-12. doi: 10.2174/1875397301105010001. Epub 2011 Jan 6.
[19] The Nrf2 System as a Potential Target for the Development of Indirect Antioxidants Kyeong-Ah Jung and Mi Kyoung Kwak * The Nrf2 System as a Potential Target for the Development of Indirect Antioxidants Kyeong-Ah Jung and Mi-Kyoung Kwak * ).
[20] Daniele Lettieri-Barbato,1,2,† Giuseppina Minopoli,3,† Rocco Caggiano,3 Rossella Izzo,3 Mariarosaria Santillo,4 Katia Aquilano,1,† and Raffaella Faraonio3,*† Fasting Drives Nrf2-Related Antioxidant Response in Skeletal Muscle Int J Mol Sci. 2020 Oct; 21(20): 7780.Published online 2020 Oct 21. doi: 10.3390/ijms21207780.
[21] Aaron J. Done and Tinna Traustadóttir⁎ Nrf2 mediates redox adaptations to exercise Published online 2016 Oct 14. doi: 10.1016/j.redox.2016.10.003 Redox Biol. 2016 Dec; 10: 191–199.
[22] Christine A. Houghton, Robert G. Fassett, and Jeff S. Coombes *Sulforaphane and Other Nutrigenomic Nrf2 Activators: Can the Clinician’s Expectation Be Matched by the Reality? Oxid Med Cell Longev. 2016; 2016: 7857186. Published online 2016 Jan 6. doi: 10.1155/2016/7857186.
[23] Shuai Jiang, Hui Liu, and Chunbao Li* Dietary Regulation of Oxidative Stress in Chronic Metabolic Diseases
Foods. 2021 Aug; 10(8): 1854. Published online 2021 Aug 11. doi: 10.3390/foods10081854.
[24] A. V. Klein,H. Kiat, Detox diets for toxin elimination and weight management: a critical review of the evidence First published: 18 December 2014 Nutritional Sciences https://doi.org/10.1111/jhn.12286.
[25] Margaret E. Sears, 1 , 2 ,* Kathleen J. Kerr, 3 , 4 and Riina I. Bray 3 , Arsenic, Cadmium, Lead, and Mercury in Sweat: A Systematic ReviewJ Environ Public Health. 2012; 2012: 184745.Published online 2012 Feb 22. doi: 10.1155/2012/184745.
[26] Alexey A. Tinkov, Thuy T. Nguyen, Abel Santamaria, Aaron B. Bowman, Aleksandra Buha Djordjevic, Monica Maria Bastos Paoliello, Anatoly V. Skalny & Michael Aschner Sirtuins as molecular targets, mediators, and protective agents in metal-induced toxicityArchives of Toxicology volume 95, pages2263–2278 (2021).
[27] Maria Elena Ferrero *Rationale for the Successful Management of EDTA Chelation Therapy in Human Burden by Toxic MetalsBiomed Res Int. 2016; 2016: 8274504.Published online 2016 Nov 8. doi: 10.1155/2016/8274504.
[28] Aoshima K. [Itai-itai disease: cadmium-induced renal tubular osteomalacia]. Nihon Eiseigaku Zasshi. 2012;67(4):455-63.
[29] Dani SU, Walter GF. Chronic arsenic intoxication diagnostic score (CAsIDS). J Appl Toxicol. 2018 Jan;38(1):122-144.
[30] D Gonzalez-Ramirez 1, M Zuniga-Charles, A Narro-Juarez, Y Molina-Recio, K M Hurlbut, R C Dart, H V Aposhian DMPS 2,3.