Objectifs :
- Comprendre la physiopathologie de la stéatose hépatique dans l’approche intégrative.
- Mettre l’accent sur l’ensemble des thérapies naturelles décrites dans la littérature scientifique.
Sommaire :
1- La stéatose hépatique, c’est quoi :
C’est une maladie chronique qui touche à peu près 200 000 personnes en France et 20 à 30 pourcent de la population au niveau de l’Amérique du Nord. Elle se caractérise par une accumulation de lipides dans le foie sous forme de triglycérides (stéatose) (>5% des hépatocytes sont atteints à l’histologie), associé à une inflammation au niveau de l’organe. Elle est souvent prévalente chez les patients souffrants de syndrome métabolique. Elle peut éventuellement évoluer vers une fibrose et une cirrhose. Dans des cas graves elle peut évoluer vers une insuffisance hépatique et un carcinome hépatocellulaire (CHC) [1].
2- Symptômes :
Les symptômes courants de la stéatose hépatique sont :
- Fatigue
- Douleur ou inconfort dans l’abdomen supérieur droit
- Les signes et symptômes possibles de la stéatose et des cicatrices avancées (cirrhose) comprennent :
- Gonflement abdominal (ascite)
- Vaisseaux sanguins élargis juste sous la surface de la peau
- Hypertrophie de la rate
- Palmiers rouges.
- Jaunissement de la peau et des yeux (jaunisse).
3- La physiopathologie de la stéatose hépatique :
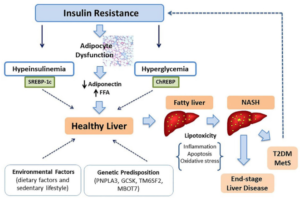
La physiopathologie de la stéatose hépatique est initiée par une accumulation des triglycérides dans les hépatocytes, au niveau histologique ce gonflement des hépatocytes est généralement associé à une formation des tissus nécrosés et une inflammation lobulaire. Cette accumulation est due à plusieurs causes parmi lesquelles :
- L’insulino résistance[2] contribue au développement de la stéatose hépatique et elle est la cause majeure :
L’insulino résistance induit une altération du métabolisme des glucides et des lipides qui se manifeste par une augmentation de la lipolyse dans les tissus adipeux périphériques, les acides gras libérés migrent vers le foie et s’incorporent aux triglycérides dans le foie. L’hyperglycémie et l’hyperinsulinémie peuvent aussi activer des facteurs de lipogenèse hépatique comme le SREBP (sterol regulatory element binding protein-1c) et CREBP (carbohydrate response element binding protein)[3].
- Le syndrome métabolique augmente le stress oxydatif au niveau du réticulum endoplasmique :
- Le syndrome métabolique induit une accumulation de graisse au niveau viscéral ce qui entraîne une élévation dans le stress oxydatif au niveau de réticulum endoplasmique des hépatocytes et l’inflammation chronique de bas grade. Ces éléments contribuent à l’augmentation de la production des protéines tronquées et le dysfonctionnement mitochondrial, conduisant à une activation des voies de signalisation apoptotiques qui peuvent aggraver les dommages hépatiques conduisant à une fibrose ou cirrhose [4]. Il faut noter que
- La dysbiose intestinale entraîne une endotoxémie métabolique (migration des toxines bactériennes vers le sang) ce qui altère le métabolisme des lipides et augmente l’inflammation.
- Facteurs génétiques :
Avec l’évolution de la technologie de l’analyse de l’ADN génomique humain par le séquençage à haut débit. Plusieurs polymorphismes génétiques ont été identifiés qui augmentent le risque de développement de la stéatose hépatique.
Une étude récente a examiné 11 polymorphismes mononucléotidiques (SNP) et les auteurs ont prouvé que trois d’entre eux (PNPLA3 rs738409, TM6SF2 rs58542926 et GCKR rs1260326) sont fortement associés à la stéatose hépatique chez les enfants ; tandis que les polymorphismes ELOVL2 rs2236212 sont corrélé avec le développement de la stéatose, indépendamment de l’âge, du sexe et de l’indice de masse corporelle [5].
Schéma expliquant la physiopathologie de la stéatose hépatique non alcoolique : (autres sources)
- Les facteurs de risque d’une stéatose hépatique :
- Taux de cholestérol élevé.
- Niveaux élevés de triglycérides dans le sang.
- Syndrome métabolique.
- Obésité, en particulier lorsque la graisse est concentrée dans l’abdomen (au niveau des viscères).
- Syndrome des ovaires polykystiques.
- Syndrome d’Apnée du sommeil.
- Diabète de type 2.
- Les maladies de la glande thyroïde (hypothyroïdie).
- Glande pituitaire sous-active (hypopituitarisme).
4- Diagnostic de la stéatose hépatique :
Le diagnostic de la stéatose hépatique se fait obligatoirement par votre médecin traitant qui peut demander des analyses biochimiques des transaminases (ASAT: Aspartate aminotransférase, ALT : alanine aminotransferase) du foie :
L’interprétation du bilan :
- ALT et AST élevées : en cas d’atteinte du foie.
- ALT et AST peuvent être normaux chez 10% des patients atteints de stéatose hépatique non alcoolique, en particulier chez les patients avec une stéatose simple.
- Il est toujours nécessaire d’exclure une stéatose en présence d’une ferritine anormale avec une saturation de la transferrine normale.
- Rapport AST/ALT < 1,ce rapport est habituellement > 2 en cas d’hépatite alcoolique.
- Votre médecin traitant peut prescrire des Tests d’imagerie typiques (échographie, scanner, ou plutôt une IRM, etc.) qui confirment une accumulation de graisses dans le foie et mesure la fibrose hépatique.
5- traitement Naturel de la stéatose hépatique :
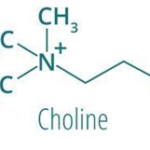
5-1. L’importance de la choline :
La choline est un nutriment hydrosoluble essentiel à la formation d’un acide aminé appelé acétylcholine : impliqué dans la transmission de l’influx nerveux, le processus d’apprentissage et de mémorisation, dans la méthylation de l’ADN et l’expression de plusieurs gènes. Mais aussi il joue un rôle métabolique important dans le foie qui protègent contre la lipogenèse excessive. En effet, selon une étude publiée dans le journal de hépatology, la déficience sévère en choline favorise le développement d’une stéatose hépatique[6] et l’injection parentérale de phosphatidylcholine entraîne un ralentissement dans la progression de la maladie [7].
Le métabolite actif de la choline la phosphatidylcholine est nécessaire pour les transports des triglycérides dans les lipoprotéines de très basse densité (VLDL) et pour la solubilisation des sels biliaires.
Les sources de choline : les œufs, le foie de bœuf, la viande rouge.
5-2. L’importance du régime alimentaire équilibré et du sport :
Plusieurs études ont souligné l’importance de sport et des diètes alimentaires équilibrées dans l’amélioration des paramètres histologiques de la stéatose hépatique non alcoolique [9, 10].
L’effet de la perte de poids a été exploré dans une étude clinique randomisée qui porte sur 154 patients atteints d’une stéatose hépatique non alcoolique. Les participants de l’étude ont suivi un régime alimentaire équilibré établi par un diététicien et ils ont adopté des exercices d’intensité modérée 3 fois par semaines. Pendant 12 mois. Les résultats ont montré une amélioration des paramètres histologiques de la stéatose (évaluée par spectroscopie de résonance magnétique) chez 64 % dans le groupe d’intervention contre seulement 20 % du groupe témoin [11].
- Le sport est indispensable :
Note : l’organisation mondiale de santé recommande pour les personnes atteint de maladies chroniques comme le diabète de type 2 et l’hypertension de pratiquer entre 150 minutes et 300 minutes d’activité physique par semaine. C’est l’équivalent de 30 minutes 5 jours par semaine. Aussi, il est souhaitable d’adopter un programme d’entraînement musculaire (exercice de résistance musculaire) 1 à 2 fois par semaine pour prévenir la sarcopénie et les fractures et réduire le risque de maladies cardiovasculaires.
- Le régime méditerranéen :
Le régime alimentaire spécifique qui convient pour les patients atteint de la stéatose hépatique n’est pas encore déterminé dans la littérature scientifique. Toutefois, il existe des régimes sains comme le régime méditerranéen qui a prouvé son efficacité dans l’amélioration de la stéatose hépatique. Selon une étude publiée dans le journal de Hépatology l’adoption du régime méditerranéen pendant 12 semaines améliore la sensibilité à l’insuline et réduit la teneur de graisse dans le foie d’une manière significative chez 12 patients diabétiques et atteints de stéatose hépatique [12].
- Le régime pauvre en glucides :
Une étude Clinique contrôlée et randomisée a comparé le suivi d’un régime pauvre en glucides durant 2 semaines (<20 g/j de glucides) par rapport à un régime hypocalorique (plage, 1200-1500 kcal/j) sur le poids et l’évolution de la stéatose hépatique chez 19 patients. Les résultats ont montré que les deux régimes ont entraîné une perte de poids similaire entre les groupes ; cependant, le groupe qui a suivi un régime restreint en glucides avait un pourcentage de réduction de la graisse hépatique (moyenne de 55 %) par rapport au groupe qui a suivi le régime hypocalorique (moyenne de 28 %) (P < 0,001) [13].
- Comment adopter un régime méditerranéen pauvre en glucide pour améliorer la stéatose hépatique :
Adopter un régime alimentaire sain comme le régime méditerranéen ou paléolithique riche en légume et fruits à index glycémique bas, protéine animale issus d’élevage naturel et graisses saines qui contribuent à la prévention contre l’hyperglycémie chronique, l’insulinorésistance et le syndrome métabolique est une stratégie efficace pour combattre la stéatose hépatique.
- Les aliments à éviter :
- Les aliments ultra transformés contenant des additifs, conservateurs, arômes artificiels.
- Les huiles végétales hydrogénées (maïs, soja, canola).
- Les glucides et les sucre raffinés.
- Les céréales génétiquement modifié OGM (maïs, soja, blé hybride).
- Les repas hypercaloriques riches en glucides et en lipides qui induisent l’hyper insulinémie postprandiale.
- Les aliments à inclure :
- Consommez Les céréales germées et le pain fermenté par la levure naturelle, le riz basmati sauvage avec modération ;
- Adoptez de l’huile d’olive à la place des huiles végétales hydrogénées ;
- Adoptez les légumes et les noix riches en fibres alimentaires comme les pois et les artichauts, les avocats, les baies, les noix et les graines, en particulier les graines de chia et les graines de lin sont riches en acides gras polyinsaturés oméga 3.
- Les protéines animales issues d’élevage naturel (poisson sauvage, poulet, viande de mouton etc) .
Voici une liste des aliments à index glycémique bas qu’il faut privilégier :
- Céréales germées, avoine, chocolat noir à 70% de cacao.
- Farine d’orge, de pois chiche, d’amande, les légumineuses (lentilles, haricots blancs).
- Fromage blanc, lait de brebis sans sucre ajouté, yaourt naturel sans sucre ajouté.
- Amandes, noix, noisettes.
- Fruits frais (papaye, raisin, melon, kiwi, litchi, pastèque, banane mûre, anchois, avocat, agave, abricot sec, coin ).
- Graines de chia, graines de sésame, de courge, tournesol, lin.
Tous ces aliments sont la base du régime méditerranéen qui est le nôtre.
5-3. La combinaison de la chardon Marie et la vitamine E
( des résultats promoteurs selon les études cliniques )
Le chardon Marie est une plante médicinale qui appartient à la famille des Asteraceae. Elle est originaire d’Europe et d’Afrique du Nord. Ses feuilles vert pâle brillantes et épineuses marbrées de blanc. Les capitules floraux sont riches en principes actifs hépato protecteurs comme complexe de flavonoïdes (Silymarine : silybine , silychristine et silydianine), des dérivés phénoliques, des mucilages, tocophérol, stérols. Ces molécules possèdent des propriétés diverses (cholagogues, cholérétiques, immunostimulant, antidiabétiques). Le complexe de Silymarine exerce une fonction protectrice contre la dégénérescence du foie causé par des xénobiotiques (alcool, tabac et médicaments). Cette action est due à la régénération des capacités antioxydantes des cellules du foie en inhibant la formation des radicaux libres et en améliorant le fonctionnement des cellules de kupffer. Selon Un Review publiée dans le journal de Biodrugs qui résume plusieurs études cliniques récentes, la silymarine permet de booster le niveau de superoxyde dismutase et de glutathion au niveau du foie chez les patients atteints de maladies hépatiques [14].
La vitamine E est une vitamine liposoluble qui protège la membrane cellulaire des cellules hépatiques contre la peroxydation lipidique. Une étude in vivo sur des souris atteint de stéatose hépatique induite par un régime déficient en choline a montré que le traitement par la vitamine E permet de restaurer le superoxyde dismutase et diminue l’expression de gènes impliqués dans l’inflammation et l’apoptose [15].
Une étude clinique randomisée publiée dans le prestigieux journal New england journal of medicine a exploré l’effet de la prise de 800 Ui / jour de vitamine E sur les paramètres de la stéatose hépatique chez 247 patients non diabétiques non cirrhotiques atteints de la stéatose hépatique. Les patients ont été subdivisés en 3 groupes . un groupe qui a reçu de la vitamine E (800 UI/jour), le deuxième groupe a été traité par pioglitazone (30 mg/jour), le troisième groupe a reçu un placebo pendant 96 semaines. Les résultats ont montré que le traitement par la vitamine E induit une amélioration significative des paramètres histologiques (43 % contre 19 %, P = 0,001) tandis que la pioglitazone n’a pas atteint la signification statistique (34 % contre 19 %, P = 0,04). Bien que la prise de la vitamine E provoque une réduction significative de la stéatose hépatique, de l’inflammation lobulaire et des troubles hépatocellulaires, aucune amélioration significative du score de fibrose n’a été observée dans les deux groupes de traitement[16].
En effet, Les auteurs d’une revue récente publiée dans current opinions in clinical nutrition and metabolism recommandent la prise de 800 Ui /jour de vitamine E chez les adultes non diabétiques et atteints de la stéatose hépatique qui n’a pas évolué vers une cirrhose [17].
Une étude clinique randomisée a exploré l’effet de la combinaison de la silymarine et la vitamine E et l’adoption d’un régime hypocalorique (1520 kcal, 52% glucides, 25% lipides et 23% protéines) pour le traitement de la stéatose hépatique non alcoolique chez 36 patients. Les résultats ont montré une amélioration significative dans le niveau des transaminases dans le foie [18].
En effet, une étude clinique contrôlée et randomisée publiée dans le journal de hépatology a évalué un traitement à base d’une combinaison de Vitamine E, L-glutathione, L-cystéine, L-méthionine et silybum marianum (chardon marie) (Epaclin 3,5 g) sous forme d’une capsule qui a été administré deux fois par jour sur les marqueurs d’inflammation et les paramètres biochimiques du foie chez 72 patients atteints de la stéatose hépatique. Les résultats ont montré que le traitement de 6 mois a amélioré de manière significative Les marqueurs hépatiques (alanine aminotransférase (ALT), aspartate aminotransférase (AST) et gamma-glutamyl transpeptidase) (P < 0,001) ainsi que l’indice d’évolution de la stéatose hépatique, (P < 0,05) [19].
5-4. Le resvératrol :
Le resvératrol (RSV : 3, 5 4′-trihydroxystilbène) est une molécule qui appartient à la classe des stilbènes, extraite du raisin rouge et d’une plante appelée renouee du Japon (Reynoutria japonica). C’est l’un des principes actifs de plantes les mieux documentés dans la littérature grâce à sa forte capacité contre l’oxydation et l’inflammation. Il permet d’activer des gènes appelés sirtuines qui ont un rôle majeur dans la réparation des dommages de l’ADN dans le foie. Mais aussi dans la bêta oxydation des lipides.
Une étude clinique randomisée qui inclut au total, 44 patients ; 28 hommes et 16 femmes âgés entre 29 et 70 ans avec une moyenne poids de 84,6 kg. Les patients ont été divisés en deux groupes de 22. Le groupe A a été traité avec du trans-resvératrol micronisé 50 mg (Evelor), et le groupe B a été traité avec micronisé trans-resvératrol 200 mg.
Les résultats ont montré que le traitement par le trans resvératrol ( 50 mg et 200 mg) réduit d’une manière significative l’accumulation de triglycérides ainsi que le niveau d’insuline plasmatique chez les patients atteints de la stéatose hépatique. Ces mécanismes hépato protecteurs sont dus à l’activation de la voie de signalisation AMPK et sirtuine 1 [20].
5-5. Les bienfaits des probiotiques pour la stéatose hépatique :
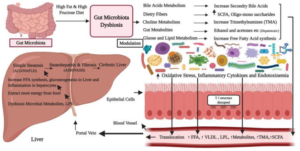
Le microbiote intestinal joue un rôle indispensable dans le maintien de la fonction immunitaire et dans le métabolisme énergétique des glucides et des lipides. La dysbiose intestinale (la perturbation de la diversité de la flore intestinale) affecte le métabolisme des glucides et des lipides de façon négative et entraîne une perturbation dans l’homéostasie énergétique dans le foie. Une Revue publiée dans International journal of biological science a montré que les patients atteints de la stéatose hépatique souffrent souvent d’une perturbation au niveau de la répartition des différents phylums bactériens (bactéroides, firmicutes, actinobactéries). Ils présentent généralement une diminution au niveau de la diversité alpha et une augmentation de la diversité bêta qui se manifeste par une abondance plus élevée de genres, Fusobactéries, une dimunition de l’abondance d’Oscillospira Ruminococcus de Ruminococcaceae et Coprococcus de Lachnospiraceae. D’autres espèces bactériennes ont été identifiées chez les patients atteints de la stéatose hépatique y comprit Proteobacteria, Escherichia et les entérobactéries.
Cette perturbation entraîne le passage des métabolites bactériens toxique vers le sang et éventuellement vers le foie où ils vont initier une activation du complexe de l’inflammosome qui joue un rôle important dans le déclenchement de la fibrose hépatique [21].
Un Schéma expliquant le rôle de la dysbiose intestinale dans le déclenchement de la stéatose hépatique [21].
Une étude clinique randomisée qui porte sur 64 enfants obèses atteint de la stéatose hépatique non alcoolique a exploré le bienfait des probiotiques sur l’évolution de la stéatose. Les patients ont été subdivisés en 2 groupes égaux. Un groupe qui a reçu un placébo et un groupe qui a reçu une capsule qui contient une combinaison de souches probiotiques (Lactobacillus acidophilus ; Bifidobacterium lactis, D ; Bifidobacterium bifidum ; Lactobacillus rhamnosus).
Les résultats ont montré que dans le groupe traité par les probiotiques, le niveau moyen d’alanine aminotransférase a diminué de 32,8 (19,6) à 23,1 (9,9) U/L (P = 0,02) et l’aspartate aminotransférase moyenne a diminué de 32,2 (15,7) à 24,3 (7,7) U/L (P = 0,02). De même il y a eu une réduction significative dans le cholestérol moyen, les lipoprotéines de basse densité LDL et les triglycérides ainsi que le tour de taille, sans changement significatif du poids, de l’indice de masse corporelle et du score de l’indice de masse corporelle. Après l’intervention, une échographie hépatique normale a été rapportée chez 17 (53,1 %) dans le groupe traité et 5 (16,5 %) dans le groupe placébo [22].
Les aliments Riches en bactéries probiotiques : Natto, Kimchi, Miso, Kombucha, légumes lactofermentés.
Références :
[1] Smith BW, Adams LA. Non-alcoholic fatty liver disease. Crit Rev Clin Lab Sci. 2011 May-Jun;48(3):97-113. doi: 10.3109/10408363.2011.596521. PMID: 21875310.
[2] Day CP, James OF. Steatohepatitis: a tale of two “hits”? Gastroenterology 1998;114:842–845.
[3] Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest 2004;114:147–152.
[4] Rinella, M. E. (2015). Nonalcoholic Fatty Liver Disease. JAMA, 313(22), 2263. doi:10.1001/jama.2015.5370.
[5] Zusi C, Mantovani A, Olivieri F, Morandi A, Corradi M, Miraglia Del Giudice E, et al. Contribution of a genetic risk score to clinical prediction of hepatic steatosis in obese children and adolescents. Dig Liver Dis (2019) 51(11):1586–92. doi: 10.1016/j.dld.2019.05.029.
[6] Buchman AL, Dubin MD, Moukarzel AA, Jenden DJ, Roch M, Rice KM, et al. Choline deficiency: a cause of hepatic steatosis during parenteral nutrition that can be reversed with intravenous choline supplementation. Hepatology 1995;22:1399-403.
[7] Karen D. Corbin and Steven H. Zeisel Choline Metabolism Provides Novel Insights into Non-alcoholic Fatty Liver Disease and its Progression Curr Opin Gastroenterol. Author manuscript; available in PMC 2013 Mar 19. Published in final edited form as:
[8] Vance DE. Role of phosphatidylcholine biosynthesis in the regulation of lipoprotein homeostasis. Curr Opin Lipidol. 2008; 19:229–234. [PubMed: 18460912]
[9] Wong VW, Chan RS, Wong GL, et al. Community-based lifestyle modification programme for non-alcoholic fatty liver disease: a randomized controlled trial. J Hepatol. 2013;59 (3):536-542.
[10] Harrison SA, Fecht W, Brunt EM, Neuschwander-Tetri BA. Orlistat for overweight subjects with nonalcoholic steatohepatitis: a randomized, prospective trial. Hepatology. 2009; 49(1):80-86.
[11] Wong VW, Chan RS, Wong GL, et al. Community-based lifestyle modification programme for non-alcoholic fatty liver disease: a randomized controlled trial. J Hepatol. 2013;59 (3):536-542.
[12] Ryan MC, Itsiopoulos C, Thodis T, et al. The Mediterranean diet improves hepatic steatosis andinsulin sensitivity in individuals with non-alcoholic fatty liver disease. J Hepatol. 2013;59(1):138-143.
[13] Browning JD, Baker JA, Rogers T, Davis J, Satapati S, Burgess SC. Short-term weight loss and hepatic triglyceride reduction: evidence of a metabolic advantage with dietary carbohydrate restriction. Am J Clin Nutr. 2011;93(5):1048-1052.
[14] Wellington K, Jarvis B. Silymarin: a review of its clinical properties in the management of hepatic disorders. BioDrugs 2001; 15: 465-489 [PMID: 11520257 DOI: 10.2165/00063030-20 0115070-00005].
[15] Nan YM, Wu WJ, Fu N, Liang BL, Wang RQ, Li LX, et al. Antioxidants vitamin E and 1- aminobenzotriazole prevent experimental non-alcoholic steatohepatitis in mice. Scandinavian journal of gastroenterology. 2009; 44(9):1121–31. Epub 2009/07/17. [PubMed: 19606393].
[16] Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. The New England journal of medicine. 2010; 362(18):1675–85. Epub 2010/04/30. This is the first large randomized controlled trial in adults that evaluated the effects of vitamin E or pioglitazone versus placebo with histological end points as primary outcome. The current AASLD recommendation of vitamin E therapy in adults is based on this trial. [PubMed: 20427778].
[17] Vitamin E and Non-alcoholic Fatty Liver Disease Tommy Pacana, MD and Arun J. Sanyal, MBBS, MD Curr Opin Clin Nutr Metab Care. 2012 November ; 15(6): 641–648. doi:10.1097/MCO. 0b013e328357f747.
[18] Hasjiani E, Hasahemi SJ. Comparison of therapeutic effects of Silymarin and Vitamin E in nonalcoholic fatty liver disease: results of an open-label, propective, randomized study. JJNPP 2009; 4: 8-14.
[19] Silymarin in non alcoholic fatty liver disease Fulvio Cacciapuoti, Anna Scognamiglio, Rossella Palumbo, Raffaele Forte, Federico Cacciapuoti World J Hepatol 2013 March 27; 5(3): 109-113 ISSN 1948-5182 (online) © 2013 Baishideng. All rights reserved.
[20] Marios Theodotou, Konstantinos Fokianos, Effect of resveratrol on non-alcoholic fatty liver disease […], and Eliza Stavrou Exp Ther Med. 2019 Jul; 18(1): 559–565. Published online 2019 May 23. doi: 10.3892/etm.2019.7607 PMCID: PMC6566048 PMID: 31316594.
[21] Understanding the Effects of Gut Microbiota Dysbiosis on Nonalcoholic Fatty Liver Disease and the Possible Probiotics Role: Recent Updates Ashiq Khan, Zitong Ding, […], and Xusheng Guo Int J Biol Sci. 2021; 17(3): 818–833. Published online 2021 Feb 8. doi: 10.7150/ijbs.56214.
[22] Famouri, Fatemeh; Shariat, Zainab; Hashemipour, Mahin; Keikha, Mojtaba; Kelishadi, Roya Effects of Probiotics on Nonalcoholic Fatty Liver Disease in Obese Children and Adolescents, Journal of Pediatric Gastroenterology and Nutrition: March 2017 – Volume 64 – Issue 3 – p 413-417 doi: 10.1097/MPG.0000000000001422.
Autres sources :
Serena Scapaticci, Ebe D’Adamo, Angelika Mohn, Francesco Chiarelli and Cosimo Giannini* Non-Alcoholic Fatty Liver Disease in Obese Youth With Insulin Resistance and Type 2 DiabetesFront. Endocrinol., 06 April 2021 | https://doi.org/10.3389/fendo.2021.639548.