Objectifs :
- Mettre l’accent sur l’effet de style de vie sain sur la santé des enfants asthmatique :
- Illustrer les différents facteurs épigénétiques contribuant à l’asthme
- Faire une sensibilisation sur la nutrition de l’enfant asthmatique et le rôle de l’éducation physique
1- L’asthme en chiffre :
L’asthme est une maladie inflammatoire chronique qui entraîne une altération de la fonction respiratoire, elle se caractérise par une sensation d’oppression dans la poitrine, une respiration sifflante et une toux sèche. L’asthme est subdivisé en plusieurs types d’expression clinique, très variable dans le temps, qui nécessite un enseignement thérapeutique et l’établissement d’une approche personnalisée et intégrative. En Amérique, 1 sur 12 souffrent d’asthme chronique, c’est-à-dire 8 pourcents de la population.
L’asthme est une des maladies chroniques les plus fréquentes, la plus fréquente de l’enfant. Elle touche en Tunisie 3% des adultes et 6-10 % des enfants [1].
2- Les différents types d’asthme :
- Asthme allergique : il débute en général dans l’enfance. Il est souvent associé à une histoire personnelle ou familiale de maladie allergique (eczéma, rhinite allergique, allergie alimentaire ou médicamenteuse). Il se caractérise par la présence d’une inflammation bronchique à éosinophiles. Le traitement médicamenteux repose essentiellement sur les corticostéroïdes inhalés. Les Allergènes les plus fréquemment impliqués sont : pollens, acariens, moisissures et squames d’animaux.
- Asthme non allergique : ce type d’Asthme est non associé à une maladie allergique. Il se caractérise notamment par une Inflammation bronchique à neutrophiles, éosinophile ou granulocytaire. Il présente généralement une réponse moins efficace aux corticostéroïdes inhalées. L’asthme non allergique est subdivisé en 2 types :
– Asthme avec obstruction bronchique fixée : Développement d’une obstruction fixée chez des patients asthmatiques de longue durée.
– Asthme à début tardif : le développement des premiers symptômes de l’asthme à l’âge adulte. L’Incidence est plus élevée chez les femmes, en général d’origine non allergique [2].
- Autres types d’asthme :
– Asthme avec intolérance à l’aspirine
– Asthme professionnel
– Asthme infectieux
– Asthme induit par l’effort physique
– Asthme dû à un traumatisme psychologique
– Asthme s’intégrant dans le cadre d’une vascularite
3- La physiopathologie et les causes de l’asthme allergique :
Selon une revue publiée dans Annual Review of médecine. La physiopathologie de l’asthme est subdivisée en plusieurs phases, une phase précoce et une phase tardive qui sont déclenchées par des anticorps IgE qui sont sensibilisés et libérés par les plasmocytes. La libération dépend de plusieurs facteurs environnementaux et d’origine alimentaires (allergènes alimentaires ou environnementaux).
Etape 1 : Les allergènes sont détectés par Les antigènes du complexe majeur d’histocompatibilité (CMH) de classe II qui les présentent aux lymphocytes T par les cellules dendritiques.
Etape 2 : Les cellules dendritiques activent une réponse immunitaire à médiation cellulaire par l’activation des lymphocytes Th2, l’élévation de taux l’interleukine 4 peut provoquer une production exagérée d’Ig E par les mastocytes.
Etape 3 : Suite à l’interaction allergène-IgE, les cellules immunitaires (mastocytes) libérant plus de médiateurs inflammatoires, L’histamine, les prostaglandines et les leucotriènes. Les lymphocytes T Th2 ensuite sécrètent plus de cytokines inflammatoires IL-4, IL-5, IL-13 exacerbant l’inflammation. Ces phénomènes conduisent à une vasoconstriction des voies respiratoires et une augmentation dans la production de mucus bronchique associé à une diminution de passage d’oxygène au niveau des alvéoles et un état de dyspnée et d’hyperventilation [3].
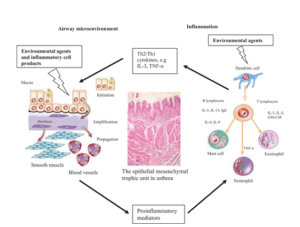
Schéma expliquant la physiopathologie de l’asthme (voir autres sources)
4- Les causes environnementales et épigénétiques de l’asthme
Les facteurs environnementaux et épigénétiques peuvent être modifiés par des mesures d’hygiène de vie et une nutrition équilibrée
4-1- La dysbiose intestinale :
Notre microbiote intestinal est un écosystème riche qui comprend plus que 40 trillions de bactéries qui comprennent plus que 1000 espèces qui sont en interaction constante avec le système immunitaire et le système neuroendocrinien. Il est estimé que notre microbiote pèse 1 à 2 kg. Les principaux phylums bactériens qui se trouvent dans notre tube digestif sont (les bactéroïdes, les firmicutes, les actinobactéries). Plusieurs études ont exploré l’effet de développement précoce de notre microbiote sur le risque de développement de l’asthme. La dysbiose intestinal est un phénomène qui se caractérise par une perturbation dans la diversité de notre microbiote avec l’émergence des souches pathogènes qui contribue au développement de l’asthme chez l’enfant. Une étude récente publiée dans le journal de Allergy and clinical immunology a montré que l’augmentation de taux de colonisation par la bactérie (Clostridium difficile) pendant l’âge de 1 mois est associé à une augmentation du risque de développement de l’asthme à l’âge de 6 à 7 ans [4]. Une autre étude a analysé le microbiote intestinal des enfants asthmatique. Durant les 100 premiers jours dès la naissance. Les chercheurs ont découvert une augmentation de l’abondance des espèces suivantes : (Lachnospira, Veillonella, Faecalibacterium (phylum de Firmicutes), Rothia (phylum des Actinobacteria) [5].
Avec l’évolution dans la technologie de séquençage génomique des bactéries et l’analyse de leurs séquences par l’approche de Métabolimics. Les chercheurs ont pu identifier la répartition des différents phylums Firmicutes (67.8 %), Actinobacteria (20.7%), Bacteriodetes (8.4 %) [6]. Les résultats ont montré une diminution de l’abondance de différentes espèces (Faecalibacterium Roseburia) appartenant au phylum des firmicutes. Cette dybiose particulière du phylum des firmicutes est observé dans plusieurs études.
Il est évident que la dysbiose intestinale est corrélée avec l’hyperperméabilité intestinale et l’inflammation. Cette inflammation peut se propager et affecter la muqueuse épithéliale pulmonaire.
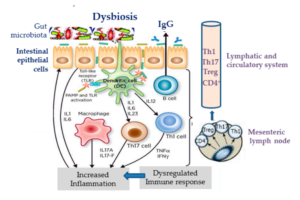
Schéma montrant le rôle de la dysbiose intestinale dans l’initiation de processus inflammatoire (autres sources)
4-2- La dysbiose pulmonaire :
Des études récentes ont exploré le rôle du microbiote pulmonaire dans la physiopathologie de l’asthme. Le microbiote pulmonaire comprend 2.2 10 à la puissance 3 bactéries par cm 2. Cette flore a attiré l’attention des chercheurs dans le domaine de la physiologie respiratoire.
Une étude qui a utilisé la technologie de séquençage NGS a comparé la composition de la flore respiratoire entre les individus asthmatique et les individus sains. Les résultats ont montré une réduction de la prévalence de l’espèce de Prevotella (appartenant au phylum des bactéries) chez les patients asthmatiques [7].
La dysbiose intestinale et pulmonaire affectent le système immunitaire d’une manière négative et contribuent au développement des maladies auto-immunes. En effet, une Revue publiée dans le journal de seminars in immunopathology a montré que la dysbiose intestinale et la perturbation de la flore respiratoire entraîne une hyperactivité de système immunitaire qui est une cause majeure de l’asthme [8].
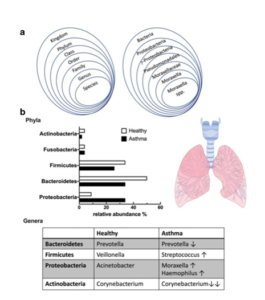
Le rôle de la dysbiose pulmonaire dans la physiopathologie de l’asthme
4-3- Les facteurs qui altèrent la diversité de la flore intestinale :
Plusieurs facteurs environnementaux peuvent altérer la diversité et la composition de la flore intestinale. Comme l’usage abusif et non contrôlé des antibiotiques et des inhibiteurs de pompes à proton. Une étude publiée dans le journal d’Aliment pharmacology research a montré que l’usage prolongé des médicaments psychotique et des inhibiteurs de pompes à proton peut conduire à la dysbiose intestinale [9] les inhibiteurs de pompes à proton en particulier entraînent une perturbation de PH gastrique ce qui favorise le passage des souches pathogènes vers l’intestin et entraîne une sur croissance qui se manifeste par une pathologie appelée SIBO (small intestin bacterial overgrowth).
L’usage prolongé des antibiotiques peut aussi causer une dysbiose. Une étude cohorte d’observation récente qui porte sur 213 661 enfants a montré que l’usage des antibiotiques chez la mère 9 mois avant la grossesse et 9 mois postpartum (après la naissance) a entraîné une augmentation significative de risque de développement de l’asthme chez les nouveau-nés [10]. 36 pourcents des enfants qui ont été exposés aux antibiotiques pendant la phase prénatale ont développé de l’asthme.
L’usage des corticoïdes peut entraîner une perturbation de la flore respiratoire. En effet, une étude publiée dans le journal de Allergy and clinical immunology a montré que l’usage des corticoïdes chez les patients asthmatiques entraîne une augmentation de l’abondance de certaines espèces bactériennes dans le tractus respiratoire associé avec l’asthme (Neisseria, Moraxella, Haemophilus) [11].
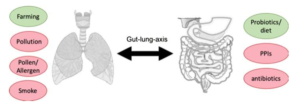
Une association de probiotiques (aliments fermentés contenant des bactéries bénéfiques) avec les prébiotiques (fibres alimentaires qui constituent un substrat sélectif pour certaines souches bactériennes) connu sous le nom de symbiotique permet de préserver l’homéostasie de la flore intestinale et prévient contre la dysbiose.
4-4- La perturbation de la balance entre les acides gras oméga 3 et les acides gras oméga 6
Selon une étude publiée dans International journal of environmental research, la carence en acide gras oméga 3 et la consommation d’une diète alimentaire riche en acide gras oméga 6 et particulièrement l’acide linoléique (AL) augmente le risque de développement de l’asthme, l’acide linoléique en excès est converti en acide arachidonique (AA), un précurseur de la prostaglandine E2 et du leucotriène B4, qui sont secrété par les mastocytes et les éosinophiles. Les prostaglandines et les leucotriènes sont de puissants broncho-constricteurs et présentent des propriétés pro-inflammatoires qui jouent un rôle très important dans la physiopathologie de l’asthme allergique [12].
Les régimes alimentaires non équilibrés riches en produits de conserve et en huiles hydrogénés et acides gras trans et régimes alimentaires riches en céréale raffiné à gluten peuvent entraîner une perturbation de la balance entre les acides gras oméga 3 et les acides gras oméga 6.
4-5- La carence en sélénium et la perturbation de la balance redox
Le sélénium est un micronutriment important pour la synthèse et le recyclage de glutathion peroxydase. un antioxydant endogène qui nous permet de lutter contre l’accumulation des espèces réactives d’oxygène. Une carence peut perturber la balance rédox et entraîner une accumulation d’espèces réactives d’oxygène. Une étude récente a montré que le sélénium est particulièrement important pour la restauration du glutathion peroxydase qui est généralement diminué chez les enfants souffrant d’asthme [13].
Une étude récente publiée dans le journal de antioxidants and redox signaling a montré que le stress oxydatif et l’accumulation d’espèces réactives d’oxygène (radical hydroxyle, H2O2) contribue à l’inflammation et le remodelage du tissu épithélial respiratoire en faveur de l’augmentation de l’hypertrophie et l’hyperplasie associé à l’asthme [14]. Chez les patients asthmatiques, le taux de glutathion plasmatique baisse et l’enzyme est plus prévalente dans le tissu branchial et alvéolaire. Chez ces patients il y a une réduction dans la production d’autres enzymes antioxydantes (Catalase, superoxyde dismutase) ce qui aggrave le stress oxydatif au niveau de la muqueuse respiratoire. Il a été démontré que l’inhalation des corticostéroïdes perturbe le rapport glutathion/glutathion S transférase dans le tissu épithélial pulmonaire, ce qui entraîne une augmentation des dommages d’ADN et de peroxydation lipidique qui vont aggraver le stress oxydatif [15].
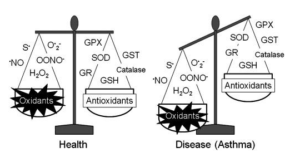
4-6- Facteurs environnementaux et exposition professionnelle :
Plusieurs facteurs environnementaux peuvent augmenter le risque de développement de l’asthme comme
- Tabagisme (actif et passif),
- La Pollution domestique et atmosphérique,
- Exposition professionnelle
- L’exposition à des allergènes comme les graines de pollen qui contiennent des molécules immunogènes (pollen associated lipid mediators) et des bactéries qui peuvent entraîner une hyper-activation du système immunitaire.
- Allergies à certaines substances irritantes (gluten, lactose, fructose) [16].
- La pollution atmosphérique joue un rôle dans le développement des pathologies respiratoires. Les hydrocarbures aromatiques polycycliques en particulier augmentent la production des espèces réactives d’oxygène dans les poumons. L’augmentation de l’exposition aux polluants atmosphériques (sulfur dioxide (SO2), nitrogen dioxide (NO2), et ozone (O3) entraîne un changement dans le microbiote en faveur de développement des maladies respiratoires [17].
- L’intoxication par des métaux lourds :
Les métaux lourds sont des minéraux présents naturellement sous forme inorganique (métallique) à l’état de traces dans l’environnement. On peut citer : arsenic, cadmium, de chrome hexavalent, le cuivre, le plomb, mercure, nickel, sélénium, tellure, thallium et l’étain.
Certains métaux sont indispensables à faible quantité (microgramme) comme (le sélénium, le Chrome, le fer). Cependant l’excès de métaux lourd dans l’organisme provoque une intoxication grave qui peut perturber l’homéostasie cellulaire et augmenter le taux de stress oxydatif dans l’organisme. L’exposition environnementale aux métaux lourds peut augmenter le risque de développement de l’asthme. En effet, Une étude publiée dans le journal de Microbiology Immunology a exploré l’association entre les concentrations sériques de métaux lourds et le risque de développement de l’asthme chez 5866 enfants âgés entre 2 et 15 ans. Les résultats ont montré que l’augmentation de la concentration sanguine de plomb est associée avec une augmentation dans le risque de développement de l’asthme et de la respiration sifflante [18]. Une autre étude a montré que l’augmentation du taux d’excrétion urinaire de métaux : cadmium, molybdène, uranium et cuivre est positivement associé avec le développement de l’asthme [19].
- Les perturbateurs endocriniens :
Les perturbateurs endocriniens sont des molécules toxiques qui perturbent les glandes endocrines sécrétrices d’hormones comme (l’axe hypothalamo hypophysaires, la glande pituitaire, la glande thyroïde, les glandes surrénales, le pancréas, les organes reproducteurs). Ces molécules sont de plus en plus prévalentes dans l’environnement et ils peuvent s’infiltrer dans la chaîne alimentaire et contaminer les sols agricoles et éventuellement les plantes et la viande des animaux comestibles.
Les sources de perturbateurs endocriniens :
Les perturbateurs endocriniens sont issus de plusieurs secteurs industriels comme :
– Certains médicaments pharmaceutiques contiennent des dioxines.
– La fabrication des plastiques des jouets (bisphénol A).
– Les tapis (contiennent les retardateurs de flammes bromés).
– Les peintures (contiennent les phtalates).
– Les produits, manger et détergents et (contiennent les phtalates, les parabènes, Cyclosiloxanes, Alkylphénols)
– Les pesticides (glyphosate).
– Les poêles téflons (contiennent les produits perfluoré comme le PFOA acide perfluorooctanoïque). Une Revue récente qui résume les résultats de 19 études rétrospectives a montré que l’exposition à des perturbateurs endocriniens comme les phtalates et le bisphénol A peut perturber la différenciation des cellules épithéliales pulmonaires et affecter négativement la réponse immunitaire innée et augmenter la réponse immunitaire adaptative TH2 ce qui peut contribuer à la physiopathologie de l’asthme [20].
5- L’approche nutritionnelle de l’enfant asthmatique :
5-1- Les probiotiques :

L’intervention la plus efficace pour la modulation de la flore intestinale et la prévention contre la dysbiose est La combinaison de probiotiques (bactéries bénéfiques) et prébiotiques (fibres alimentaires qui fournissent une source d’énergie pour notre microbiote et constituent un substrat sélectif pour les différentes bactéries). Ces bactéries vont métaboliser ces prébiotiques pour fabriquer des post biotiques (des acides gras à chaîne courte) qui favorisent la stabilité et l’intégrité de la barrière intestinale. Plusieurs études précliniques ont montré que la modulation du microbiote intestinal permet de réduire l’hypersensibilité du système immunitaire et l’inflammation. Il a été démontré que le traitement des souris asthmatiques par une souche de lactobacillus Rhamnus entraîne une réduction dans le niveau de MMP9 et inhibe l’infiltration des macrophages inflammatoires dans le tissu épithélial pulmonaire [21].
Une étude clinique randomisée a exploré l’effet de la supplémentation avec des probiotiques sur le statut inflammatoire des enfants asthmatique. Les résultats ont montré que la prise des probiotiques a entraîné une inhibition de la réponse immunitaire Th2 et par conséquence une réduction de la production des cytokines 5 et 13[22].
Une méta-analyse qui résume 17 études cliniques randomisées qui portent sur 5 264 enfants souffrant d’asthme. Les résultats ont montré qu’il n’y a pas une réduction notable dans le risque de développer de l’asthme après une supplémentation en probiotiques. Un sous-groupe a présenté une réduction dans le développement de l’asthme après prise d’une souche spécifique (Lactobacillus rhamnosus) [23]. Les chercheurs ont conclu que la supplémentation avec les probiotiques est une approche préventive efficace durant la période prénatale et postnatale.
Les meilleures sources de probiotiques (aliments fermentés : Miso, choucroute, kemchi, Kombucha, légumes lactofermentés).
Les meilleures sources de prébiotiques : fruits et légumes, miel, les fructo oligosides (l’orge, la chicorée, l’ail, l’asperge, l’oignon ou l’artichaut,tomates, banane, poireaux), galactooligosaccharides (haricots, pois, pois chiche, légumes secs, tubercules), disaccharides (lactose, produits laitiers), inuline (chicorée, l’agave, l’ail, l’asperge), cellulose (végétaux verts) et artichauts.
5-2- Le régime Méditerranéen anti-inflammatoire :
La manière la plus efficace pour combattre l’inflammation, c’est d’adopter un régime anti-inflammatoire. Tout simplement éviter les aliments inflammatoires et privilégier les aliments anti-inflammatoires. Une méta-analyse récente publiée dans le journal de Asthma and allergy a exploré l’effet de l’adoption du régime méditerranéen sur les symptômes de l’asthme. Les résultats ont montré que ce régime assure un rôle protecteur contre le développement de l’asthme et la respiration sifflante [24].
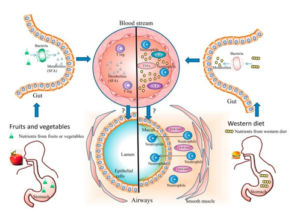
Il a été démontré que la consommation d’un régime alimentaire riche en fruits et légumes exerce un effet anti-inflammatoire. Comme il réduit la production des cytokines inflammatoires dans le plasma et dans le tractus respiratoire et diminue la teneur en neutrophiles chez les enfants asthmatiques. Les fruits et les légumes contiennent aussi des fibres prébiotiques qui constituent un substrat sélectif pour la prolifération des souches probiotiques qui vont métaboliser ces fibres pour produire des acides gras à chaîne courte à propriétés immunomodulatrices et anti-inflammatoires [25]. Selon une étude rétrospective réalisée en Espagne qui porte sur 460 enfants. L’adoption du régime méditerranéen chez la mère pendant la grossesse réduit le risque de développement de l’asthme chez les enfants [26].
Schéma montrant le rôle anti-inflammatoire de la consommation des fruits et légumes et le rôle inflammatoire du régime occidental de Fast Food [25].
Aliments inflammatoires à éviter :
- Les aliments riches en oméga 6 : les huiles hydrogénées (la margarine), les huiles végétales : de palme, de colza, de canola, de maïs. Certains de ces huiles comme l’huile de palme peut augmenter le passage des LPS (lipopolysaccharides) de l’intestin vers le sang, ce qui engendre une inflammation et une hyperperméabilité intestinale.
Note : Les oméga 6 sont des acides gras polyinsaturés indispensables à notre organisme, mais ils sont aujourd’hui consommés en excès par rapport aux oméga 3.
“Parmi les acides gras oméga 6, on retrouve l’acide linoléique, un précurseur de l’acide arachidonique qu’on sait pro-inflammatoire
- Glucides raffinés, comme le pain blanc et les pâtisseries, céréales à gluten.
- Aliments ultra-transformés.
- Les produits conservés (arômes artificiels et colorants alimentaires).
- Les produits contenant du soja et du maïs génétiquement modifié.
- Frites et autres aliments cuits en
- Boissons gazeuses et autres boissons sucrées.
- Viande transformée (hot dogs, saucisses, salami).
- Viandes issues d’élevage non naturel, rempli d’antibiotiques et d’
Le régime alimentaire contenant en abondance ces aliments contribue à l’élévation dans le taux de cytokines inflammatoires (Tumor necrosis factor alpha (TNF-α), interleukin-6 (IL-6) et la protéine C réactive- (CRP) ce qui augmente le risque de développement de l’asthme.
Les aliments anti-inflammatoires à privilégier :
- L’huile d’olive
- Le Miel
- Les légumes à feuilles vertes, comme les épinards, le chou frisé…
- Les noix comme les amandes et les noisettes
- Les poissons gras comme le saumon, le maquereau, le thon et les sardines ; les poissons (sauvages, pas d’élevage).
- Les fruits comme les fraises, les bleuets, les cerises, les oranges, les pommes, les dattes
- Les épices anti-inflammatoires : comme le curcuma, le romarin.
- La farine de petit épeautre, châtaigne, maïs, sarrasin, seigle, pois chiches, blé ancestrale (Kamut), riz
- Les légumineuses avec modération : Haricot vert, pois chiche, petit pois
- Légumes verts riches en magnésium (persil, épinards, Artichaut, céleri)
- Les fruits riches en vitamine C : orange, citron, Kiwi, baies d’acérola.
5-3- Le régime sans gluten :
Avec l’émergence du blé hybride et la diminution de la disponibilité du blé ancestral. L’intolérance au gluten a augmenté d’une façon extraordinaire même chez les personnes non atteintes de la maladie cœliaque. Mais pourquoi consommant nous du blé depuis des millions d’années ? Bien évidemment, le pain d’aujourd’hui contient 5 fois plus de gluten que le pain ancestral. Pour des raisons de panifications, les industries ajoutent du gluten dans le pain et les pâtisseries pour augmenter l’élasticité de la patte.
Le gluten est la partie protéique du blé. Il est formé par deux molécules : la gliadine et l’agglutinine. La gliadine exerce un effet pro-inflammatoire qui perturbe l’intégrité et la fonction de la barrière intestinale [26]. On sait clairement que cette inflammation intestinale peut contribuer à la dysbiose qui est un facteur de risque majeur de développement des allergies respiratoires et de l’asthme. En effet, une étude rétrospective récente qui porte sur 19,572,740 individus publiés dans le journal de Digestive disease and science a montré que les patients atteints de la maladie de cœliaque ont plus de risque de développer de l’asthme [27].
Il faut noter que pour certaines populations défavorisées dans le troisième monde (en Tunisie) qui adoptent une alimentation basée sur les produits à base de blé. Ce n’est pas possible d’éliminer complètement le blé car il apporte la majorité de l’apport calorique et des protéines. Chez ces populations, d’autres moyens peuvent être envisagés comme :
- La réduction de la consommation de blé hybride et l’adoption du blé ancestral
- La fermentation du pain avec la levure naturelle (levain) est une méthode ancestrale qui permet de réduire d’une façon significative la teneur en gluten du blé.
- La consommation d’autres céréales en conjonction comme : Le Riz sauvage, Le Millet, Le sarrasin, Le sorgho, l’avoine.
5-4- Les acides gras oméga 3 :

Les acides gras oméga 3 sont des acides gras essentiels polyinsaturés ( qui contiennent une double liaison dans leur structure tridimensionnelle). On peut différencier 3 molécules
- L’acide docosahexaénoïque (DHA): un acide gras à 22 atomes de carbones, c’est l’acide gras le plus abondant notamment dans le cortex cérébral.
- L’acide eicosapentaénoïque (EPA) : un acide gras à 20 atomes de carbones, il joue un rôle précurseur pour la synthèse de prostaglandines 3 et inhibe l’agrégation des thrombocytes L’EPA réduit la production de l’acide gras oméga 6 (acide arachidonique) ce qui limite la production des médiateurs inflammatoires (les eicosanoïdes).
Les acides gras EPA et DHA sont plus abondants dans les produits Marins : les poissons gras, (sardines, saumon, maquereau, Herring) huile de poisson, huile de foie de Morue.
- L’acide alpha linolénique(ALA) : est un acide gras à 18 atomes de carbone de chaîne courte qui peut être converti en EPA et DHA par une famille d’enzymes appelée désaturases, cependant cette conversion est faible : de l’ordre de 5 à 8 pourcent chez les humains. L’acide alpha linolénique (ALA) est plus abondant : dans l’huile d’olive, l’huile de lin, l’huile de sésame, noix, oléagineux, amandes, graines de chia, huile d’avocat.
Les acides gras oméga 3 jouent un rôle anti-inflammatoire et protecteur contre le développement de plusieurs pathologies inflammatoires, y compris l’Asthme.
Une étude épidémiologique récente qui porte sur 642 sujets asthmatiques a montré que l’augmentation des concentrations sériques en acides gras oméga 3 est associée avec une réduction du risque de développement de l’asthme. Par contre, l’augmentation des concentrations sériques en acide gras oméga 6 est associée avec une augmentation du risque de développement de l’asthme [28].
Une étude clinique randomisée publiée dans le journal d’Allergy and clinical immunology qui porte sur 533 femmes en période de grossesse a montré que la supplémentation en huile de poisson riche en acides gras oméga 3 (2.7 g) pendant le troisième trimestre de la grossesse contribue à réduire d’une manière significative la survenue de l’asthme chez les nouveau-nés [29]. Une étude similaire a montré que la supplémentation avec les acides gras oméga 3 durant le troisième trimestre de la grossesse entraîne une réduction de la survenue de la respiration sifflante et de l’asthme de 7 pourcents chez les nouveaux nés [30].
5-5- Apprendre à lire les étiquettes chez l’enfant asthmatique :
Pour que l’enfant devienne conscient de certaines molécules toxiques qui pourrait contaminer les aliments ultra transformés. Il est important d’apprendre aux enfants comment lire les étiquettes des aliments achetés dans les grandes surfaces et les sensibiliser à propos du danger de ces substances.
Quelques additifs sont tout à fait sécuritaires et sans danger comme : le sorbate de potassium, acide citrique, curcumine , riboflavine, etc.
Certains additifs sont dangereux pour les enfants et peuvent provoquer des effets nocifs sur la santé et augmenter le risque de développement des pathologies inflammatoires si consommé quotidiennement.
Ci-joint une liste non exhaustive de ces molécules
|
Code |
Nom |
Risque |
|
E 421 |
Mannitol |
Acidité, déshydratation, calculs rénaux, etc |
|
E 450a |
Diphosphates disodiques |
Hyperactivité, mauvaise assimilation des minéraux, troubles digestifs, diminution de croissance, baisse de fertilité |
|
E 471 E 472a E 472b E472c |
Mono et diglycérides d’acides gras et leurs esters acétiques, lactiques et citriques |
Problèmes de croissance, réduction des organes reproducteurs |
|
E 473 |
Sucroesters d’acides gras |
Problèmes intestinaux. Peut-être cancérigène. Considéré par certains comme inoffensif |
|
E 525 |
Hydroxyde de potassium |
Sensations de brûlure dans le tube digestif supérieur, hémorragies et malaises. |
|
|
Dioxyde de titane |
Cancérogène |
|
|
Nitrite et nitrate |
Cancérigènes |
|
(GMS ou MSG) |
Glutamate monosodique
|
Allergies cutanées Induction des symptômes de l’asthme |
|
|
Aspartame |
Neurotoxique |
|
|
Tartrazine
|
Urticaire et eczéma pendant l’âge adulte |
Une étude publiée dans le journal de Immunology and Allergy clinic a montré que certains agents additifs et conservateurs sont associés avec le développement des symptômes de l’asthme : sulfure dioxide, sodium sulfite, sodium and potassium bisulfite, metabisulfites. Les agents contenant les sufites constituent les agents allergènes les plus documentés dans la littérature. Ces agents peuvent exacerber les bronchospasmes chez les enfants [31].
Le MSG ( monosodium glutamate) est une molécule qui a été utilisée depuis longtemps comme additif dans les chips et les biscuits pour donner un goût salé . Une revue récente dans la littérature a exploré l’effet de l’exposition à 2.5 g de MSG chez 30 patients asthmatiques. 2 patients ont présenté des bronchospasmes après l’ingestion. Ces effets sont dus à des mécanismes cholinergiques [32].
5-6- Compléments alimentaires bénéfiques :
- Le sélénium et le N acétyl cystéine peuvent aider à équilibrer la balance redox cellulaire.
- La spiruline et La chlorelle : permettent de renforcer le système immunitaire et favoriser la détoxification des composés toxiques, métaux lourds et perturbateurs endocriniens (chlorelle).
- La levure de bière peut aider dans la reconstitution d’une flore intestinale saine et équilibrée.
5-7- La place de l’exercice physique :
L’exercice physique aérobique est encouragé pour les enfants atteints d’asthme pour améliorer le fonctionnement du système respiratoire comme : (le Yoga, la marche, la bicyclette, natation). En effet, une étude clinique randomisée publiée dans le journal de rehabilitation medecine et qui porte sur 62 enfants asthmatiques a montré que l’adoption d’un programme d’entraînement aérobique de basketball pendant 8 semaines a provoqué une amélioration significative des symptômes de l’asthme mesuré par le score de (PAQLQ score) et une amélioration dans la fonction respiratoire pulmonaire et la qualité de vie des patients [33].
5-8- Le rythme chronobiologique et l’importance du sommeil :
Plusieurs patients asthmatiques rapportent une altération dans leur qualité de sommeil causé par l’exacerbation des symptômes (toux, congestion, bronchospasmes) pendant la nuit, une étude récente qui porte sur 200 patients asthmatiques a montré que 66 pour cent souffrent de perturbations dans la qualité de sommeil et 43 pour cent souffrent d’obstruction bronchique et de syndrome d’apnée de sommeil [34].
Le centre de contrôle des maladies américain (center for disease control (CDC)) recommande aux enfants d’avoir un sommeil récupérateur de 8 à 10 heures par jour.
Références :
[1] Asthme : Recommandationsde La Société Tunisiennedes Maladies Respiratoiresetd’Allergologie Agnès Hamzaoui, Karim Rekik, Sonia Maalej, Anissa Berraies, Maher Abouda, Nadia Mhiri, Neila Zalila, Jouda Cherif, Raoudha Boussofara, Insaf Ben Jrad, Farès Mili, Abdelwaheb Fekih, Majed Béji, Fatma Tritar, Mohamed Ridha Charfi La tunisie Medicale – 2017 ; Vol 95 ( n°08 ) : 714-721.
[2] Padem N, Saltoun C. Classification of asthma. Allergy Asthma Proc. 2019 Nov 1;40(6):385-388. doi: 10.2500/aap.2019.40.4253. PMID: 31690376.
[3] Maddox, L., & Schwartz, D. A. (2002). The Pathophysiology of Asthma. Annual Review of Medicine, 53(1), 477–498. doi:10.1146/annurev.med.53.082901.
[4] Van Nimwegen FA, Penders J, Stobberingh EE, Postma DS, Koppelman GH, Kerkhof M, Reijmerink NE, Dompeling E, van den Brandt PA, Ferreira I, Mommers M, Thijs C. Mode and place of delivery, gastrointestinal microbiota, and their influence on asthma and atopy. J Allergy Clin Immunol. 2011;128(948–55):e1.
[5] Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, Kuzeljevic B, Gold MJ, Britton HM, Lefebvre DL, Subbarao P, Mandhane P, Becker A, McNagny KM, Sears MR, Kollmann T, Investigators CS, Mohn WW, Turvey SE, Finlay BB. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Sci Transl Med. 2015;7:307ra152. doi: 10.1126/scitranslmed.aab2271.
[6] Chiu CY, Cheng ML, Chiang MH, Kuo YL, Tsai MH, Chiu CC, Lin G. Gut microbial-derived butyrate is inversely associated with IgE responses to allergens in childhood asthma. Pediatr Allergy Immunol. 2019;30:689–697. doi: 10.1111/pai.13096.
[7] Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, Davies J, Ervine A, Poulter L, Pachter L, Moffatt MF, Cookson WO. Disordered microbial communities in asthmatic airways. PLoS One. 2010;5:e8578. doi: 10.1371/journal.pone.0008578.
[8] Hufnagl K, Pali-Schöll I, Roth-Walter F, Jensen-Jarolim E. Dysbiosis of the gut and lung microbiome has a role in asthma. Semin Immunopathol. 2020 Feb;42(1):75-93. doi: 10.1007/s00281-019-00775-y. Epub 2020 Feb 18. PMID: 32072252; PMCID: PMC7066092.
[9] Le Bastard Q, Al-Ghalith GA, Gregoire M, Chapelet G, Javaudin F, Dailly E, Batard E, Knights D, Montassier E. Systematic review: human gut dysbiosis induced by non-antibiotic prescription medications. Aliment Pharmacol Ther. 2018;47:332–345. doi: 10.1111/apt.14451.
[10] Loewen K, Monchka B, Mahmud SM, t Jong G, Azad MB. Prenatal antibiotic exposure and childhood asthma: a population-based. study Eur Respir J. 2018;52:1702070. doi: 10.1183/13993003.02070-2017.
[11] Durack J, Lynch SV, Nariya S, Bhakta NR, Beigelman A, Castro M, Dyer AM, Israel E, Kraft M, Martin RJ, Mauger DT, Rosenberg SR, Sharp-King T, White SR, Woodruff PG, Avila PC, Denlinger LC, Holguin F, Lazarus SC, Lugogo N, Moore WC, Peters SP, Que L, Smith LJ, Sorkness CA, Wechsler ME, Wenzel SE, Boushey HA, Huang YJ, National Heart L, Blood Institute’s, A Features of the bronchial bacterial microbiome associated with atopy, asthma, and responsiveness to inhaled corticosteroid treatment. J Allergy Clin Immunol. 2017;140:63–75. doi: 10.1016/j.jaci.2016.08.055.
[12] Adams, Shahieda et al. “Relationship between Serum Omega-3 Fatty Acid and Asthma Endpoints.” International journal of environmental research and public health vol. 16,1 43. 25 Dec. 2018, doi:10.3390/ijerph16010043.
[13] Norton RL, Hoffmann PR. Selenium and asthma. Mol Aspects Med. 2012;33(1):98-106. doi:10.1016/j.mam.2011.10.003.
[14] Fitzpatrick AM, Jones DP, Brown LA. Glutathione redox control of asthma: from molecular mechanisms to therapeutic opportunities. Antioxid Redox Signal. 2012;17(2):375-408. doi:10.1089/ars.2011.4198.
[15] Fitzpatrick AM. Teague WG. Burwell L. Brown MS. Brown LA. Glutathione oxidation is associated with airway macrophage functional impairment in children with severe asthma. Pediatr Res. 2011;69:154–159.
[16] Pénard-Morand C, Raherison C, Kopferschmitt C, Caillaud D, Lavaud F, Charpin D, Bousquet J, Annesi-Maesano I. Prevalence of food allergy and its relationship to asthma and allergic rhinitis in schoolchildren. Allergy. 2005 Sep;60(9):1165-71. doi: 10.1111/j.1398-9995.2005.00860.x. PMID: 16076302.
[17] Chotirmall SH, Gellatly SL, Budden KF, Mac Aogain M, Shukla SD, Wood DL, Hugenholtz P, Pethe K, Hansbro PM. Microbiomes in respiratory health and disease: An Asia-Pacific perspective. Respirology. 2017 Feb;22(2):240-250. doi: 10.1111/resp.12971. PMID: 28102970.
[18] Wu KG, Chang CY, Yen CY, Lai CC. Associations between environmental heavy metal exposure and childhood asthma: A population-based study. J Microbiol Immunol Infect. 2019 Apr;52(2):352-362. doi: 10.1016/j.jmii.2018.08.001. Epub 2018 Aug 22. PMID: 30177433.
[19] Huang X, Xie J, Cui X, Zhou Y, Wu X, et al. (2016) Association between Concentrations of Metals in Urine and Adult Asthma: A Case-Control Study in Wuhan, China. PLOS ONE 11(5): e0155818. https://doi.org/10.1371/journal.pone.0155818.
[20] Casas M, Gascon M. Prenatal Exposure to Endocrine-Disrupting Chemicals and Asthma and Allergic Diseases. J Investig Allergol Clin Immunol. 2020;30(4):215-228. doi: 10.18176/jiaci.0580. Epub 2020 Jun 3. PMID: 32490822.
[21] Wu CT, Chen PJ, Lee YT, Ko JL, Lue KH. Effects of immunomodulatory supplementation with Lactobacillus rhamnosus on airway inflammation in a mouse asthma model. J Microbiol Immunol Infect (2016) 49:625–35.10.1016/j.jmii.2014.08.001] .
[22] Gorissen DM, Rutten NB, Oostermeijer CM, Niers LE, Hoekstra MO, Rijkers GT, van der Ent CK. Preventive effects of selected probiotic strains on the development of asthma and allergic rhinitis in childhood. The Panda study. Clin Exp Allergy. 2014 Nov;44(11):1431-3. doi: 10.1111/cea.12413. PMID: 25227163.
[23] Du X, Wang L, Wu S, Yuan L, Tang S, Xiang Y, Qu X, Liu H, Qin X, Liu C. Efficacy of probiotic supplementary therapy for asthma, allergic rhinitis, and wheeze: a meta-analysis of randomized controlled trials. Allergy Asthma Proc. 2019 Jul 1;40(4):250-260. doi: 10.2500/aap.2019.40.4227. PMID: 31262380.
[24] Lv N, Xiao L, Ma J. Dietary pattern and asthma: a systematic review and meta-analysis. J Asthma Allergy. 2014;7:105-121. Published 2014 Aug 12. doi:10.2147/JAA.S49960.
[25] Guilleminault, Laurent et al. “Diet and Asthma: Is It Time to Adapt Our Message?.” Nutrients vol. 9,11 1227. 8 Nov. 2017, doi:10.3390/nu9111227.
[26] Chatzi L, Torrent M, Romieu I, et al Mediterranean diet in pregnancy is protective for wheeze and atopy in childhood Thorax 2008;63:507-513.
[27] Freire R, Ingano L, Serena G, Cetinbas M, Anselmo A, Sapone A, Sadreyev RI, Fasano A, Senger S. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 2019 May 7;9(1):7029. doi: 10.1038/s41598-019-43426-w. PMID: 31065051; PMCID: PMC6505524.
[28] Yaqoob, Z., Al-Kindi, S. G., & Zein, J. (2016). Association Between Celiac Disease and Asthma. Digestive Diseases and Sciences, 61(12), 3636–3637. doi:10.1007/s10620-016-4321-0.
[29] Hansen S., Strom M., Maslova E., Dahl R., Hoffmann H.J., Rytter D., Bech B.H., Henriksen T.B., Granstrom C., Halldorsson T.I., et al. Fish oil supplementation during pregnancy and allergic respiratory disease in the adult offspring. J. Allergy Clin. Immunol. 2017;139:104–111.e4. doi: 10.1016/j.jaci.2016.02.042.
[30] Bisgaard H., Bonnelykke K. Fish Oil in Pregnancy and Asthma in Offspring. N. Engl. J. Med. 2017;376:1191–1192.
[31] Spergel, J. M., & Fiedler, J. (2005). Food allergy and additives: triggers in asthma. Immunology and Allergy Clinics of North America, 25(1), 149–167. doi:10.1016/j.iac.2004.09.012.
[32] Moneret-Vautrin DA. Monosodium glutamate-induced asthma: study of the potential risk of 30 asthmatics and review of the literature. Allerg Immunol (Paris) 1987;19:29 – 35.
[33] Basaran S, Guler-Uysal F, Ergen N, Seydaoglu G, Bingol-Karakoç G, Ufuk Altintas D. Effects of physical exercise on quality of life, exercise capacity and pulmonary function in children with asthma. J Rehabil Med. 2006 Mar;38(2):130-5. doi: 10.1080/16501970500476142. PMID: 16546771.
[34] Alanazi, T.M., Alghamdi, H.S., Alberreet, M.S. et al. The prevalence of sleep disturbance among asthmatic patients in a tertiary care center. Sci Rep 11, 2457 (2021). https://doi.org/10.1038/s41598-020-79697-x.
[35] Loseva, L. P., & Dardynskaya, I. V. (1993, September). Spirulina-natural sorbent of radionucleides. In 6th International Congress of Applied Algology, Czech Republic.
Autres sources:
Review Lung Microbiome in Asthma: Current Perspectives Konstantinos Loverdos 1 , Georgios Bellos 2 , Louiza Kokolatou 2 , Ioannis Vasileiadis 1 , Evangelos Giamarellos 3 , Matteo Pecchiari 4 , Nikolaos Koulouris 1 , Antonia Koutsoukou 1 and Nikoletta Rovina 1, J. Clin. Med. 2019, 8, 1967; doi:10.3390/jcm8111967