Sommaire :
1- Comment fonctionne la glande thyroïde :
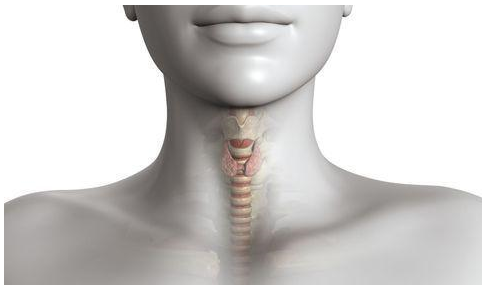
La glande thyroïde est une petite glande endocrine de l’ordre de 5 cm de diamètre, située sous la peau de cou. Elle est subdivisée en deux lobes connectés par une partie centrale appelée isthme. La glande thyroïde est responsable de la sécrétion des hormones thyroïdiennes T4 : Thyroxine (également appelée tétraïodothyronine) et T3 : Triiodothyronine. Cette production se fait par l’intermédiaire des follicules formés d’épithélium simple, de cellules folliculaires (thyréocytes) qui délimitent une cavité. L’espace folliculaire contient la substance colloïde, lieu de stockage des hormones thyroïdiennes sous forme de thyroglobuline. Les cellules claires paravésiculaires sont responsables de la synthèse de la calcitonine impliquée dans la régulation de la calcémie. La synthèse des hormones thyroïdiennes se fait selon les étapes suivantes :
- L’absorption de l’iode : La synthèse des hormones thyroïdiennes se fait grâce à l’iode sous forme d’iodure, I– ou d’iodate, IO3– qui sont absorbés par le tube digestif.
- L’iode se fixe sur la thyroglobuline et la tyrosine grâce à la peroxydase. Cette étape se fait dans le colloïde ou la partie centrale des follicules thyroïdiens. Cette étape aboutit à la formation de 2 molécules monoiodotyrosine (MIT) et de diiodotyrosine (DIT). (Le sélénium est indispensable dans cette étape).
- La synthèse de T3 se fait par l’assemblage d’une molécule de MIT et une molécule de DIT.
- La synthèse de T4 se fait par l’assemblage de 2 molécules de DIT et une molécule de MIT.
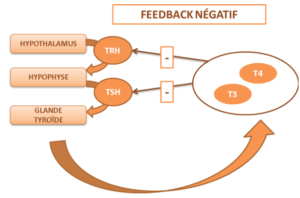
L’ensemble thyroglobuline, avec ses molécules T3, T4, MIT et DIT, est stocké dans le colloïde. Ils sont ensuite libérés par les thyrocytes sous l’action de la TSH (throide stimulating hormone). Ces hormones T3 et T4 contrôlent principalement la vitesse de métabolisme énergétique de base (c’est-à-dire au repos) par un effet anabolique stimulant de la synthèse des protéines et par l’augmentation de l’oxygénation cellulaire. La production des hormones thyroïdiennes est sous contrôle de l’axe hypothalamo-hypophysaire. L’hypothalamus stimule l’hypophyse par la TRH ce qui active la sécrétion de TSH (thyroïde stimulating hormon) responsable de l’activation de la production des hormones thyroïdiennes T3 et T4.
Schéma montrant le rôle de l’axe hypothalamo-hypophysaire dans le contrôle de l’activité de la glande thyroïde
Selon un Review publié dans le journal de endocrinology metabolisme, immune desorder, l’iode et le sélénium jouent un rôle très important dans le bon fonctionnement de la glande thyroïde. Ils sont nécessaires pour la production des hormones T4 et T3 et pour la conversion de T4 en T3 [1]. D’autres sels minéraux comme le zinc et le cuivre, fer sont aussi importants pour le bon fonctionnement de la glande thyroïde.
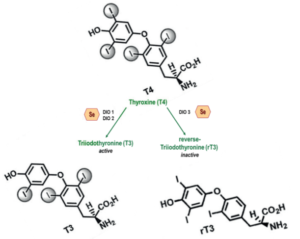
Métabolisme des hormones thyroïdiennes :
Il faut noter que la T4 peut être convertie en T3 par monodéiodation et la dioadation contribue à la formation de l’hormone T3 inactive appelée aussi reverse T3.
Schéma expliquant la conversion de T4 en T3 et T3 inactivée
Rôle des hormones thyroïdiennes
- Dégradation enzymatique des macromolécules (glucides, protéines, lipides)
- La régulation de la température corporelle
- La régulation du rythme cardiaque et de la pression artérielle
- La régulation de la respiration
- Le fonctionnement normal du système nerveux
- Le développement du cerveau chez les enfants
- Régulation du métabolisme cellulaire, la synthèse de l’ADN et la phosphorylation mitochondriale
- Croissance musculaire et staturo pondérale
2- Physiopathologie de l’hypothyroïdie :
L’hypothyroïdie est une maladie de la glande thyroïde qui se caractérise par une production insuffisante d’hormones thyroïdiennes. T4 et T3 sont impliqués dans le métabolisme de toutes les cellules. La production de T4 et de T3 dépend de la production de thyréostimuline (TSH) par l’hypophyse. Toute perturbation dans le niveau de T3 et T4 va affecter la TSH. Dans ce cas, l’hypothalamus essaye de compenser la carence des hormones en sécrétant la TSH. C’est pourquoi l’hypothyroïdie se caractérise par un niveau plus élevé que la normale de TSH. Le traitement standard de l’hypothyroïdie consiste à l’administration d’un traitement hormonal de levothyroxine [2].
3- Épidémiologie et risques
L’hypothyroïdie touche 0 à 2% de la population à l’États-Unis et 3 à 5 % en Europe [3,4]. Elle touche généralement les femmes âgées de plus de 65 ans. L’hypothyroïdie est un facteur de risque de la maladie rénale chronique (MRC).
4- Signes cliniques :
- Fatigue persistante
- Perte de poids inexpliquée
- Une soif exagérée
- Hypersensibilité (irascibilité)
- irritabilité
- Insomnies
- Diarrhées
- Palpitations cardiaques et tremblements
- Des yeux qui ont tendance à sortir de leur orbite
- Apparition d’un goitre visible, suite à l’augmentation du volume de la thyroïde
- Irrégularité du pouls
- Bouffées de chaleur
- Le syndrome des ovaires polykystiques (hypothyroïdie/hyperthyroïdie).
Les causes :
Les causes d’hypothyroïdie primaire :
- La thyroïdite d’Hashimoto est essentiellement d’origine auto-immune
- La thyroïdite de De Quervain est d’origine infectieuse
- Cause iatrogène (thyroïdectomie au radioiode, effets secondaires de certains médicaments comme l’amiodarone, l’hypothyroïdie pouvant être transitoire, cédant à l’arrêt du traitement, ou définitive)
- Maladie infiltrative (sarcoïdose, amyloïdose, hémochromatose…)
- Trouble enzymatique de la thyroïde (génétique)
- Dysgénésie thyroïdienne congénitale
- Consommation d’aliments goitrigènes
- La carence en iode constitue la première cause d’émergence de l’hypothyroïdie dans le monde [5]
- Plusieurs maladies chroniques peuvent augmenter le risque de développement de l’hypothyroïdie comme le diabète de type 1, la maladie cœliaque
- La consommation de l’alcool et de tabac constituent aussi une cause majeure [6,7]
- Le sélénium et le zinc jouent un rôle important dans la conversion de l’hormone T4 en T3 et la carence en ces micronutriments essentiels peut perturber le fonctionnement de la glande thyroïde [8].
- Les maladies inflammatoires de l’intestin : leaky gut syndrome
- Facteurs génétiques : comme l’hypothyroïdie congénitale
- Un stress chronique avec des niveaux élevés d’adrénaline et de cortisol
- Un stress oxydatif excessif peut conduire à une déficience en zinc et une perturbation des niveaux de TRH sécrétée par l’hypothalamus qui est indispensable pour la sécrétion de TSH et la stimulation de la fonction thyroïdienne.
Les causes de l’hypothyroïdie secondaire
- L’inflammation de la glande thyroïde
- L’hypophyse fabrique une hormone appelée hormone thyréostimuline (TSH) qui contrôle les niveaux d’hormones thyroïdiennes, un problème avec l’hypophyse peut entraîner des modifications de la fonction thyroïdienne.
- La baisse dans la production de TSH par l’hypophyse
4-1-Prise en charge nutritionnelle en cas d’hypothyroïdie :
L’approche nutritionnelle a pour but d’apporter les nutriments nécessaires au bon fonctionnement de la glande thyroïde. Les cellules folliculaires absorbent l’iode et le sélénium présent dans le sang et l’utilisent pour produire les hormones T4 et T3. Donc pour fonctionner normalement, la thyroïde a besoin de deux oligo-éléments essentiels. Il est aussi important d’éviter l’exposition aux minéraux halogènes et perturbateurs endocriniens qui perturbent le fonctionnement de la glande thyroïde. Le régime alimentaire équilibré qui exclut les aliments ultra-transformés et les huiles hydrogénées et qui inclut des fruits, des légumes biologiques, des céréales ancestrales et des produits animaux issus d’élevage naturel, est indispensable pour le traitement du fond de l’hypothyroïdie.
- Les aliments à éviter :
- Les aliments ultra-transformés contenant des additifs, conservateurs, arômes artificiels ;
- Les huiles végétales hydrogénées (colza, maïs, soja, canola) ;
- Les glucides et le sucre raffiné ;
- Les céréales génétiquement modifié OGM (maïs, soja, blé hybride).
Les repas hypercaloriques riches en glucides et en lipide qui induisent l’hyper insulinémie postprandiale.
- Les aliments à inclure :
- Consommer les céréales germées, le pain fermenté par la levure naturelle et le riz basmati sauvage avec modération ;
- Adopter de l’huile d’olive à la place des huiles végétales hydrogénées ;
- Adopter les légumes et les noix riches en fibres alimentaires comme ( les pois, les artichauts, les avocats, les baies, les noix et les graines, en particulier les graines de chia et les graines de lin) ;
- Les protéines animales issues d’élevage naturel (poisson sauvage, poulet, viande de mouton etc…).
L’importance de l’iode :
La seule fonction physiologique connue de l’iode est son rôle dans le métabolisme thyroïdien, ce qui fait d’un apport optimal en iode un enjeu crucial. Chez un adulte en bonne santé, le corps contient de 15 à 20 mg d’iode, dont 70 à 80% sont présents dans la glande thyroïde. Les aliments les plus riches en iode sont les algues, les crustacés, les poissons, les œufs et les produits laitiers. [9,10]. L’apport journalier recommandé en iode est de l’ordre de 150 microgrammes par jour.
L’importance de sélénium :
La thyroïde est très riche en sélénium, dont la concentration est inversement associée au volume de la glande thyroïde. Le sélénium assure une double fonction : il est indispensable à la synthèse des hormones thyroïdiennes et il protège, avec les GPx (glutathion peroxydase), la glande thyroïde des dommages oxydatifs. Les iodothyronines désiodases (DIO) sont des séléno enzymes qui catalysent la transformation des T4 en T3 par déiodation. Dans certaines pathologies, l’expression des DIO peut être perturbée et entraîner une hypothyroïdie. Les aliments riches en sélénium sont : Noix du Brésil, Poissons gras, Fruits de mer Viandes et volailles, Champignons Shiitake, Œufs. L’apport journalier recommandé en sélénium est de 50 microgrammes par jour et la forme la plus assimilée est la sélénométhionine.
Autres sels minéraux importants pour le bon fonctionnement de la glande thyroïde :
Le zinc et le cuivre sont importants pour le fonctionnement du superoxyde dismutase et la catalase qui sont importants pour lutter contre le stress oxydatif qui altère le fonctionnement de la glande thyroïde. Les déficits en zinc entraînent des altérations du fonctionnement de l’axe hypothalamus-hypophyse-thyroïde. La carence en zinc modifie en effet l’activité de la pyroglutamyl aminopeptidase (PPII), une enzyme présente dans l’hypothalamus, cruciale pour la dégradation de la TRH. Une diminution de l’activité de la PPII conduit à une augmentation de la concentration en TRH ce qui déclenche une augmentation de la TSH et une déplétion de taux d’hormones thyroïdiennes. Le fer est aussi important pour le bon fonctionnement de la glande thyroïde. En effet, une étude récente montre que la carence en fer entraîne une baisse dans la production des hormones thyroïdiennes T3 et T4 chez les enfants qui souffrent de goitre [11].
4-2 -les perturbateurs endocrinien comme facteurs de risque de la perturbation de la glande thyroïde :
Les pesticides et les phtalates : Les perturbateurs endocriniens perturbent la production des hormones thyroïdiennes par exemple une exposition à des organophosphorés (ométhoate, parathion-méthyle, méthamidophos) peut déclencher une augmentation de TSH et de T4 et la réduction de T3 selon une étude publiée dans le journal de Toxicology and Applied Pharmacology [12]. Les phtalates sont des plastifiants que l’on retrouve dans les sacs plastiques, les jouets, les emballages alimentaires et les voitures, et qui ont des effets néfastes sur la fonction thyroïdienne. Selon une étude publiée dans le journal de Environmental Health Perspectives et qui porte sur 1300 adultes. Les résultats ont montré une réduction significative des T4 et T3 en présence de phtalates [13]. D’autres molécules comme les tensioactifs fluorés, les parabènes et les plastifiants, perturbent le fonctionnement de la glande thyroïde.
4-3 -Les aliments goitrigènes :
Évitez la surconsommation d’aliments goitrigènes qui ralentissent le fonctionnement de la thyroïde et la production des hormones thyroïdiennes ce qui aggrave la maladie. Ces aliments contiennent les glycosides cyanogéniques qui interfèrent avec le fonctionnement de la peroxydase de la glande thyroïde [14]. Certains végétaux crucifères contiennent des glucosinolates [15]. Selon un Review publié dans le journal de Nutrition Review, ces molécules se dégradent et forment la goitrin et le thiocyanates. L’apport élevé de ces produits intermédiaires de glucosinolate peut entraîner une compétition avec la fixation de l’iode sur son récepteur au niveau de la glande thyroïde ce qui entraîne une carence par défaut d’absorption d’iode [16]. Les chercheurs de Review ont montré aussi que les végétaux crucifères possèdent des composés anticancéreux bénéfiques et l’activité goitrogénique survient seulement suite à une surconsommation de ces aliments.
- Liste des aliments goitrigènes :
Chou de Bruxelles/Chou/Chou-fleur/Chou frisé/Brocoli/ Feuilles de moutarde/ Cresson /Navet/ Rutabaga/Patates douces/ Fèves de soja /Arachides/ Millet.
4-4- Les minéraux halogènes et les métaux lourds et leur rôle dans l’hypothyroïdie :
Les personnes atteints de l’hypothyroïdie doivent éviter les minéraux halogènes comme fluore, brome et le cobalt qui entrent en compétition avec les récepteurs d’iode au niveau de la glande thyroïde et inhibent son absorption et les métaux lourds comme le mercure, le plomb et le cadmium qui altèrent la fonction thyroïdienne. Une étude publiée dans international journal of environmental research a montré que l’exposition au fluorure altère l’absorption de l’iode par l’inhibition de transporteur à sodium au niveau de la glande thyroïde [17]. Plusieurs études montrent que le brome aussi interfère avec la captation de l’iode par les cellules folliculaires thyroïdiennes. Chez les modèles animaux et l’homme l’accumulation de brome induit une inhibition compétitive du transport de l’iode dans la glande. Il peut aussi induire des altérations des structures cellulaires conduisant à une réduction de T4 et T3 dans le sang [18,19,20]. Le cobalt est un élément minéral qui inhibe l’entrée de l’iode par son récepteur. Il faut noter que la déficience en cobalt peut engendrer une baisse dans la production de T3. Un excès peut aussi engendrer du goitre et une déficience dans la production des deux hormones thyroïdiennes T3 et T4 [21 ,22]. Des études chez des rats atteints de goitre ont montré que certains métaux lourds comme le mercure et le cadmium altèrent le fonctionnement de la glande thyroïde par l’inhibition de l’action de sélénium et la synthèse des hormones thyroïdiennes. En effet un Review publié dans international journal of molecular science montre que le cadmium peut favoriser l’apparition des tumeurs au niveau de la glande thyroïde [23].
- Sources des minéraux halogènes: Dentifrice fluoré, eau fluoré, pesticides (glyphosate), engrais chimiques, retardateurs de flammes bromées peintures, caoutchouc et plastiques.
- Sources de mercure: Grand poisson prédateurs et crustacés (privilégiez les petits poissons comme les sardines), piles et batteries, thermomètres et baromètres, industries d’or et de charbon, les amalgames dentaires à base de mercure et certains produits cosmétiques.
- Sources de cadmium : Tabac, décharges industrielles, engrais du sol, eaux usées, industries de raffinage de métaux non ferreux, combustion du charbon et des produits pétroliers, détergents.
5- La place des plantes médicinales dans l’hypothyroïdie selon les études cliniques :
5-1- La racine d’ashwagandha (600 mg / jour) :

L’ashwagandha est une plante médicinale adaptogène qui aide le corps à répondre au stress. Elle favorise l’équilibre hormonal. Les adaptogènes aident à réduire le cortisol et à équilibrer le niveau de T4. Dans un essai clinique contrôlé et randomisé publié dans le journal de complementary and intégrative medicine, la supplémentation en ashwagandha pendant huit semaines, aide les patients atteints d’hypothyroïdie à augmenter considérablement les niveaux d’hormones thyroxine et tridi thyronine [24].
5-2- Le Fucus vesiculosus :
Fucus vesiculosus est une espèce d’algues brun marine qui appartient à la famille des Fucaceae. Elle contienne de l’acide alginique ou alginate qui fait souvent partie des ingrédients des antiacides destinés à contrer les effets des reflux gastriques. Elle contienne aussi un polysaccharide comme le fucoidan à propriété anticancéreuse [25]. Cette plante se caractérise par sa richesse en iode, ce qui est bénéfique pour l’hypothyroïdie causée par déficience en iode. Selon une étude in vivo chez les lapins publiée dans le journal de analytical biochemestry, le fucus est capable de réguler le taux d’hormones thyroïdiennes [26]. Cette algue est tout à fait contre-indiquée en cas d’hyperthyroïdie, car elle contienne 600 µg d’iode par gramme d’algue. C’est pratiquement 3 fois plus que la dose journalière recommandée (150 µg) . Remarque : Consultez votre médecin ou votre pharmacien pour optimiser votre dose.
5-3- Laminaria digitata :
Laminaria digitata ou japonica est une espèce qui appartient aux algues brunes et à la famille des Laminariaceae. Cette algue de couleur brune vert-olivâtre, est prévalente surtout dans la mer du Nord, dans la Baltique occidentale, dans l’océan Atlantique et dans l’océan Pacifique. Cet algue se caractérise par sa teneur en vitamines et sels minéraux comme le fer, le calcium, magnésium, l’iode et en pigments antioxydants xanthophylles telles que la fucoxanthine qui possède des composés anticancéreuses [27]. Cette plante peut être utilisée comme un complément alimentaire sécuritaire à base d’iode. En effet selon une étude clinique publiée dans le journal clinical pediatric and endocrinology et qui porte sur 7 enfants qui souffrent de retard mental, les chercheurs ont exploré la fonction thyroïdienne après la prise de 2 grammes d’extrait de laminaria (qui contient 200 à 400 microgrammes d’iode). Les résultats ont montré que la prise de l’extrait améliore la fonction thyroïdienne [28]. Dans une autre étude clinique publiée dans le journal d’endocrinology practice, qui porte sur 36 individus sains, les résultats ont montré que la prise de complément de laminaria pendant 4 semaines, stimule la production de TSH (thyroïde stimulating hormone) par l’hypophyse, ce qui augmente le niveau de production de thyroxine et triiodothyronine [29]. Il ne faut pas abuser de la consommation de laminaire car une dose excessive de 20 grammes peut ralentir le fonctionnement de la glande thyroïde [30].
5-4- Coleus forskohlii :
C’est une plante médicinale utilisée en médecine ayurvédique traditionnelle qui appartient à la famille des lamiacées. Elle est originaire des montagnes d’Asie. Le Coleus contient des huiles essentielles et un diterpène appelé forskohlii, qui régule la thermogenèse et la lipolyse. Ce principe actif permet l’activation de l’adénylate cyclase, ce qui augmente la production et la sécrétion d’hormones thyroïdiennes T3 et T4 [31]. Evitez les plantes inhibitrices de la glande thyroïde : Dans le cadre d’une hypothyroïdie il faut éviter à tout prix l’utilisation les plantes frénatrices de l’action de la glande thyroïde comme la sauge ( salvia officinale ), la mélisse (mélissa , officinalis), lycope d’Europe (lycopus europaeus), romarin (Rosmarinus officinalis) et Bugleweed (Lycopus virginicus). Par contre il faut les adopter en cas d’hyperthyroïdie [32].
Le kaempférol: le flavonoïde le plus puissant dans la stimulation de la fonction thyroïdienne.
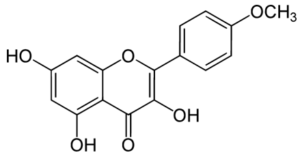
Le kaempférol est une molécule antioxydante qui appartient à la famille des flavonoïdes. Il est présent dans plusieurs plantes médicinales comme la saphora japonica, menthe poivré et dans plusieurs aliments tels que : les fraises, les poireaux et les épinards. Ce pigment possède une couleur jaune et il possède des propriétés antioxydantes stimulatrices de la production des glutathion peroxydases, ce qui protège contre les radicaux libres, qui provoquent une déplétion du zinc et une altération de la fonction de la glande thyroïde [33]. Cette molécule stimule la sécrétion des hormones thyroïdiennes par l’activation de l’AMP cyclique et l’iodothyronine désiodase de type II (D2) [34].
6- Compléments alimentaires bénéfiques en cas d’hypothyroïdie :
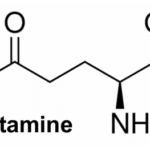
6-1- La tyrosine :
La L-tyrosine est un acide aminé impliqué dans la synthèse des hormones thyroïdiennes. La consommation des aliments riches en L-tyrosine est cruciale pour optimiser le fonctionnement de la glande thyroïde. Selon une étude publiée dans l’American journal of médecine. Les patients atteints d’hypothyroïdie souffrent d’une baisse de 70 pourcents de taux du tyrosine dans le sang [35]. Les sources alimentaires de L-tyrosine : œuf, lait, viande rouge, amande, noix et avocat.
6-2- Les vitamines de groupe B :
Les vitamines de groupe B (B1 , B2 ,B3 , B6 , B9 , B12) et en particulier la vitamine B12 sont importants pour la synthèse des neurones et le bon fonctionnement de la glande thyroïde. Selon une étude clinique comparative qui porte sur 116 patients atteints d’hypothyroïdie, les analyses biochimiques ont montré qu’ils présentent une carence en vitamine B12 [36]. Les sources alimentaires de vitamine de groupe B : Les levures de bière, les noix, ainsi que les abats, les légumes secs ou verts, les fruits, les produits laitiers, la spiruline et la chlorelle.
- Les probiotiques :
Le microbiote qui habite le système digestif comprend des microorganismes (bactéries, champignons , virus) dont la majorité colonisent l’intestin. Ces bactéries jouent un rôle très important dans des nombreux processus métaboliques : la digestion, la synthèse des vitamines, le métabolisme énergétique, le système immunitaire, l’intégrité et la fonction de la barrière intestinale, le fonctionnement du système nerveux central. Selon une étude publiée dans le journal de trend in endocrinology and metabolism, la flore intestinale équilibrée est un élément indispensable dans l’absorption, l’assimilation des vitamines et sels minéraux et en particulier l’iode et le sélénium qui sont des éléments indispensables pour le fonctionnement de la thyroïde [37]. Les aliments fermenté comme le miso, le vinaigre de kombucha, le sauerkraut permettent de supporter la diversité bactérienne de la flore intestinale ce qui améliore la synthèse de la vitamine B12 et l’absorption de l’iode et de sélénium.
Références :
[1] Vincenzo Triggiani 1, Emilio Tafaro, Vito Angelo Giagulli, Carlo Sabbà, Francesco Resta, Brunella Licchelli, Edoardo Guastamacchia Endocr Metab Immune Disord Drug Targets . 2009 Sep;9(3):277-94. doi: 10.2174/187153009789044392. Epub 2009 Sep 1. Role of iodine, selenium and other micronutrients in thyroid function and disorders.
[2] Layal Chaker, Antonio C Bianco, Jacqueline Jonklaas, and Robin P Peeters Hypothyroidism Lancet. Author manuscript; available in PMC 2019 Jul 10. Published in final edited form as: Lancet. 2017 Sep 23; 390(10101): 1550–1562.Published online 2017 Mar 20. doi: 10.1016/S0140-6736(17)30703-1.
[3] Changes in the prevalence of hypothyroidism: the HUNT Study in Norway. Asvold BO, Vatten LJ, Bjøro T Eur J Endocrinol. 2013 Nov; 169(5):613-20.
[4] Serum TSH, T (4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, Braverman LE J Clin Endocrinol Metab. 2002 Feb; 87(2):489-99.
[5] Iodine intake as a determinant of thyroid disorders in populations. Laurberg P, Cerqueira C, Ovesen L, Rasmussen LB, Perrild H, Andersen S, Pedersen IB, Carlé A Best Pract Res Clin Endocrinol Metab. 2010 Feb; 24(1):13-2.
[6] Moderate alcohol consumption may protect against overt autoimmune hypothyroidism: a population-based case-control study. Carlé A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB, Jørgensen T, Laurberg P Eur J Endocrinol. 2012 Oct; 167(4):483-90.
[7] Tobacco smoking and thyroid function: a population-based study. Asvold BO, Bjøro T, Nilsen TI, Vatten LJ Arch Intern Med. 2007 Jul 9; 167(13):1428-32.
[8] Bianco AC et al. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine
selenodeiodinases. Endocrine Reviews, 2002, 23, 38–89.
[9] O’Kane, S. M. et al. Micronutrients, iodine status and concentrations of thyroid hormones: a systematic review. Nutrition Reviews, 2018, 76(6), 418–431.
[10] Zimmermann, M. B. Symposium on “Geographical and geological influences on nutrition” Iodine deficiency in industrialised countries. Proceedings of the Nutrition Society, 2009, 69(01), 133.
[11] Zimmermann, M.B. and Köhrle, J. (2002) The impact of iron and selenium deficiencies on iodine and thyroid metabolism: biochemistry and relevance to public health. Thyroid, 12(10), 867-878.
[12] Lacasaña, M. et al. Association between organophosphate pesticides exposure and thyroid hormones in floriculture workers. Toxicology and Applied Pharmacology, 2010, 243(1), 19–26.
[13] Meeker, J. D. & Ferguson, K. K. Relationship between Urinary Phthalate and Bisphenol: Concentrations and Serum Thyroid Measures in U.S. Adults and Adolescents from the National Health and Nutrition Examination Survey (NHANES) 2007–2008. Environmental Health Perspectives, 2011, 119(10), 1396–1402.
[14] Fluoride Exposure Induces Inhibition of Sodium/Iodide Symporter (NIS) Contributing to Impaired Iodine Absorption and Iodine Deficiency: Molecular Mechanisms of Inhibition and Implications for Public Health March 2019 International Journal of Environmental Research and Public Health 16(6):1086.
[15] Chandra, A.K.; Mukhopadhyay, S.; Lahari, D. and Tripathy, S. (2004) Goitrogenic content of Indian cyanogenic plant foods and their in vitro antithyroidal activity. Indian J. Med. Res., 119(5), 180-185.
[16] Peter Felker, Ronald Bunch, and Angela M. Leung Concentrations of thiocyanate and goitrin in human plasma, their precursor concentrations in brassica vegetables, and associated potential risk for hypothyroidism Nutr Rev. 2016 Apr; 74(4): 248–258.Published online 2016 Mar 5. doi: 10.1093/nutrit/nuv110.
[17] Galletti, P.M. and Joyet, G. (1958) Effect of fluorine on thyroidal iodine metaoblism in hyperthyroidism. J. Clin. Endocrinol. Metab., 18(10), 1102-1110.
[18] Clode, W.; Sobral, J.M. and Baptista, A.M. (1961) Bromine interference in iodine metabolism and its goitrogenic action. R. PittRivers (eds), Advances in Thyroid Research, Pergamon Press, New York, pp; 65.
[19] Vobeck, M.; Babick, A.; Lener, J. and Svandová, E. (1996) Interaction of bromine with iodine in the rat thyroid gland at enhanced bromide intake. Biol. Trace Elem. Res., 54(3), 207-212.
[20] Velick, J.; Titlbach, M.; Dusková, J.; Vobeck, M.; Strbák, V. and Raska, I. (1997) Potassium bromide and the thyroid gland of the rat: morphology and immunohistochemistry, RIA and INAA analysis. Ann. Anat., 179(5), 421-431.
[21] Stangl, G.I., Schwartz, F.J. and Kirchgessner, M. (1999) Cobalt deficiency effects on trace elements, hormones and enzymes involved in energy metabolsim in cattle. Int. J. Vitam. Nutr. Res., 69(2), 120-126.
[22] Barceloux, D.G. and Cobalt. J. Toxicol. Clin. Toxicol., (1999), 37(2), 201-206.
[23] Aleksandra Buha,1,* Vesna Matovic,1 Biljana Antonijevic,1 Zorica Bulat,1 Marijana Curcic,1 Elisavet A. Renieri,2 Aristidis M. Tsatsakis,2 Amie Schweitzer,3 and David Wallace3 Overview of Cadmium Thyroid Disrupting Effects and Mechanisms Int J Mol Sci. 2018 May; 19(5): 1501. Published online 2018 May 17.
[24] Ashok Kumar Sharma 1, Indraneel Basu 1, Siddarth Singh 1Efficacy and Safety of Ashwagandha Root Extract in Subclinical Hypothyroid Patients: A Double-Blind, Randomized Placebo-Controlled Trial J Altern Complement Med. 2018 Mar;24(3):243-248. doi: 10.1089/acm.2017.0183. Epub 2017 Aug 22.
[25] Marcelo D. Catarino, Artur M. S. Silva, and Susana M. Cardoso* Phycochemical Constituents and Biological Activities of Fucus spp.Mar Drugs. 2018 Aug; 16(8): 249.Published online 2018 Jul 27.
[26] Role of Fucus vesiculosus L extract in the regulation of thyroid hormones status in adult male rabbits December 2017 Project: Bioanalytical Chemistry.
[27] Se-Kwon Kim 1, Ira Bhatnagar Physical, chemical, and biological properties of wonder kelp—Laminaria Adv Food Nutr Res Affiliations expand Adv Food Nutr Res 2011;64:85-96. doi: 10.1016/B978-0-12-387669-0.00007-7.
[28] Takako Takeuchi 1, Hotaka Kamasaki, Tomoyuki Hotsubo, Hiroyuki Tsutsumi Treatment of Hypothyroidism due to Iodine Deficiency Using Daily Powdered Kelp in Patients Receiving Long-term Total Enteral Nutrition Clin Pediatr Endocrinol 2011 Jul;20(3):51-5. doi: 10.1297/cpe.20.51. Epub 2011 Oct 7.
[29] Clifford D Clark 1, Bertram Bassett, Mark R Burge Effects of kelp supplementation on thyroid function in euthyroid subjects Endocr Pract Sep-Oct 2003;9(5):363-9.
[30] Kiyoshi Miyai 1, Tomoyasu Tokushige, Masahiko Kondo, Iodine Research Group Suppression of thyroid function during ingestion of seaweed “Kombu” (Laminaria japonoca) in normal Japanese adults. 2008 Dec;55(6):1103-8. doi: 10.1507/endocrj.k08e-125. Epub 2008 Aug 9. Endocr J Collaborators, Affiliations expand.
[31] P Laurberg Forskolin stimulation of thyroid secretion of T4 and T3 FEBS Lett. 1984 May 21;170(2):273-6.
[32] Eric Yarnell Botanical Medicine for Thyroid Regulation June 2006Alternative and Complementary Therapies 12(3):107-112DOI:10.1089/act.2006.12.107.
[33] Shakya, G. et al. Hepatoprotective role of kaempferol during alcohol- and ΔPUFA-induced oxidative stress. Journal of Basic and Clinical Physiology and Pharmacology, 2014, 25(1).
[34] DiWagner S da-Silva 1, John W Harney, Brian W Kim, Jing Li, Suzy D C Bianco, Alessandra Crescenzi, Marcelo A Christoffolete, Stephen A Huang, Antonio C Bianco.The small polyphenolic molecule kaempferol increases cellular energy expenditure and thyroid hormone activation diabète . 2007 Mar;56(3):767-76.
[35] Rivlin, R. S., & Asper, S. P. (1966). Tyrosine and the thyroid hormones. The American Journal of Medicine, 40(6), 823–827.
[36] Abdul Jabbar 1, Aasma Yawar, Sabiha Waseem, Najmul Islam, Naeem Ul Haque, Lubna Zuberi, Ataullah Khan, Jaweed Akhter Vitamin B12 deficiency common in primary hypothyroidism J Pak Med Assoc . 2008 May;58(5):258-61.
[37] Microbiota and Thyroid Interaction in Health and Disease Author links open overlay panelEleonoreFröhlich12RichardWahl1 Show more Add to Mendeley Share Cite.
Auteurs :