Objectifs : Élaborer une approche intégrative qui tient compte de tous les composants physiopathologiques impliqués dans la maladie.
Sommaire :
1- La maladie d’Alzheimer :
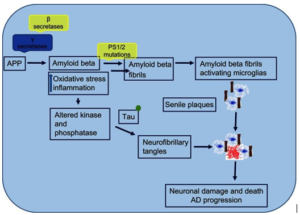
La maladie d’Alzheimer est une maladie neurodégénérative qui se caractérise par une altération de la fonction cognitive, de la mémoire et de la concentration. Elle touche 47 millions de personnes dans le monde et il est estimé que ce chiffre va atteindre 131 millions à 2050. Aux États-Unis, cette maladie handicapante touche 5.3 millions dont 5.1 âgés plus que 65 ans. Les dommages au niveau du cerveau sont dus essentiellement à l’accumulation d’agrégat de protéines comme les plaques amyloïdes béta et des protéines hyperphosphorylées dans la région corticale et limbique du cerveau. Ce dérèglement peut être causé par une multitude de facteurs : génétiques, épigénétiques (hygiène de vie, nutrition) [1].
2- Physiopathologie et causes de la maladie d’Alzheimer :
Au niveau histologique, le cerveau des patients atteints de la maladie d’Alzheimer se caractérise par une accumulation extracellulaire de plaques amyloïdes bêta et une accumulation intracellulaire d’agrégats neurofibrillaires (NFT), qui sont composés de protéines de microtubules hyperphosphorylés. Dans les premiers stades des maladies. Les plaques amyloïdes se forment principalement dans la région de néocortex cérébral et la région basale. Dans les stades avancés, ces plaques se forment dans plusieurs autres régions : néocortex, hippocampes, amygdale et diencéphale. Cette accumulation de plaques amyloïdes entraine une infiltration des cellules de microglie (macrophages résidents dans le système nerveux central) qui engendrent une réponse inflammatoire auto-immune qui contribue à la destruction des neurones et l’altération dans la transmission de l’influx nerveux [2].
- Le manque de la signalisation neurotrophique comme principal facteur :
Avec l’évolution de la recherche en biologie moléculaire. Plusieurs facteurs ont été identifiés comme contributeurs dans la formation des plaques amyloïdes bêta. Le facteur majeur est le manque des protéines de signalisation qui assurent la neurogenèse et la neuroplasticité (qui sont importants pour assurer une fonction cognitive optimale) comme le NGF (nerf growth factor) et BDNF (brain derived neurotrophic factor). Ces signalisations sont importantes pour la survie des neurones à l’âge adulte. Ils sont stimulés principalement par le jeune (12 à 16 heures) et par l’exercice physique. La déficience en ces facteurs peut contribuer au clivage des plaques par les sécretases pour former les plaques amyloïdes bêta [3]. Les plaques amyloïdes vont être clivées en 2 types bêta et gamma qui vont conduire à la formation des peptides anti-trophiques comme sAPPβ, Aβ, Jcasp, et C31. La perturbation de la balance entre les peptides neurotrophiques et les peptides antitrophiques va initier un processus inflammatoire qui va être initié par le NFKB (nuclear factor κ-light chain enhancer of B cells).
Plusieurs autres facteurs peuvent conduire à une déficience dans la signalisation neurotrophique comme : l’exposition aux métaux lourds, tel que le mercure qui conduit à l’accélération dans la formation des plaques amyloïdes bêta [4].
- Rôle du stress oxydatif et du dysfonctionnement mitochondrial (lien avec le diabète) :
Il a été démontré que le stress oxydatif chronique altère la capacité redox mitochondriale dans le cerveau et cela peut conduire à une augmentation du risque de développement de la maladie d’Alzheimer et contribue à la formation des plaques amyloïdes bêta et d’agrégats neurofibrillaires (NFT). L’accumulation des marqueurs de peroxydation lipidique sont souvent observés chez les patients atteints d’Alzheimer [5].
Une étude publiée dans le journal de Neuroscience research a montré que les patients atteints de la maladie d’Alzheimer présentent des signes de dysfonctionnement mitochondrial [6]. Les mitochondries sont des organites qui assurent la production de l’ATP (énergie) pour la survie des neurones. L’usage continue de glucose par les mitochondries à travers la phosphorylation oxydative mitochondriale conduit à l’accumulation d’espèces réactives d’oxygène comme H2O2, hydroxyl (HOU) superoxide (O2-). Dans un état physiologique normale, ces espèces seront éliminées par les enzymes anti-oxydantes, catalase, superoxyde dismutase et glutathion peroxydase. La déficience en ces enzymes altère la capacité redox mitochondriale conduisant à des dommages dans l’ADN et un stress oxydatif neuronal qui contribue à la physiopathologie de la maladie d’Alzheimer [7]. Ce phénomène est aggravé par l’insulino-résistance cérébrale qui conduit à la formation des produits de glycation avancés.
Selon le facteur en cause, plusieurs sous types de la maladie d’Alzheimer ont été identifiés [4] :
- Type 1 : Inflammatoire causé par une inflammation excessive au niveau du cerveau dont les signes sont : CRP élevé (protéine C-réactive à haute sensibilité), faible rapport albumine/ globuline et taux élevé de cytokines tels que l’interleukine-1 et l’interleukine-6.
- Type 1,5 (mixte) : Glycotoxique suite à l’accumulation d’AGE (produits de glycations avancées) dans le cerveau en cas de diabète non contrôlé par exemple.
- Type 2 : Atrophique : Le profil atrophique se caractérise avec une réduction dans la signalisation neurotrophique telles que l’œstradiol, la progestérone, le facteur neurotrophique dérivé du cerveau (BDNF), le facteur de croissance nerveux (NGF), la testostérone, diminution du taux de la vitamine D, souvent accompagnés d’une augmentation de l’homocystéine et de l’insuline résistance, et le stress oxydatif.
- Type 3 toxique : il se manifeste par une accumulation de toxines qui dépassent la barrière hématoencéphalique : métaux lourds comme le mercure par exemple, alcool ou tabac.
- Type 4 : vasculaire causé par une artériosclérose ou manque de circulation sanguine cérébrale pendant le sommeil ou syndrome d’apnée de sommeil.
- Type 5 : traumatique : causé par un choc traumatique (comme le traumatisme crânien).
Il existe 4 stades de la maladie d’Alzheimer : aucune déficience, trouble cognitif légère, modéré, modérément sévère, et très sévère.
3- Approche intégrative du traitement de la maladie d’Alzheimer :
3-1- Augmenter la signalisation neurotrophique par le jeune et certains compléments alimentaires :
L’autophagie joue un rôle crucial dans la physiologie neuronale. Elle permet le recyclage des mitochondries dysfonctionnelles et l’activation de la production des facteurs de croissance neuronale comme le BDNF et le NGF. Elle exerce un effet neuroprotecteur contre l’hypoxie et l’accumulation de sous métabolites toxiques. De cette façon, elle favorise la survie des neurones et la transmission optimale de l’influx nerveux [8].
- En pratiquant le jeûne intermittent au minimum 12 h par jour, on soutient l’autophagie et la production de bêta hydroxybutyrate à effet protecteur contre la neuro-inflammation.
- Augmenter le NGF (nerf growth factor) par le champignon (hericium erinaceus et acetyl-Lcarnitine) : Hericium erinaceus (Lion’s mane).
Il s’agit d’une espèce de champignon qui appartient à la famille des Hericiaceae . Elle a prouvé son efficacité dans l’augmentation du taux de facteur NGF (nerf growth factor) dans le cerveau. Une étude clinique randomisée publiée dans le journal de frontiers in aging and neuroscience a exploré l’effet de la consommation d’une capsule de 350 mg de champigons Hericium pendant 49 semaines sur les capacités cognitives, des patients atteints de la maladie d’Alzheimer. Les résultats ont montré une amélioration significative dans les scores de compétences cognitives et le test de mémorisation (Mini Mental State (MMS). Il y a eu une amélioration aussi dans les scores de IADL (évaluation des activités instrumentales de la vie quotidienne) dans le groupe traité [9]. La posologie optimale est de l’ordre de 350 à 500 mg 2 fois par jour
- Acetyl-L-carnitine (ALCAR) : Il s’agit d’une forme acétylée de l’acide aminé L-carnitine. L’organisme est capable de synthétiser La L-carnitine à partir de deux acides aminés (lysine et méthionine). Cette synthèse requière la présence de plusieurs cofacteurs comme (la vitamine C, le fer, la vitamine B6 et la vitamine B3). Il intervient dans le processus de production de l’ATP par les mitochondries. Des preuves scientifiques ont montré que l’acétyl-L carnitine peut franchir la barrière hémato-encéphalique et jouer un rôle d’antioxydant dans le cerveau. Une étude publiée dans le journal de neuroscience réalisée sur un modèle de rats a montré que le Acetyl-L carnitine protège contre l’hypoxie et la perte de la mémoire en activant le facteur NRF2 (impliqué dans l’activation de la synthèse endogène des enzymes antioxydantes endogène) [10]. Une autre étude réalisée sur des rats âgés a montré que l’Acétyle L carnitine a permis de restaurer l’activité du NGF (nerf growth factor) et l’activité de la choline acétyle-transférase [11]. Une étude clinique publiée dans le journal de Alzheimers Disease and Parkinsonism, a utilisé une dose (500 mg par jour) de N acétylcystéine et il y a eu une amélioration notable dans les performances cognitives de 100 patients [4].
- L’exercice physique : L’exercice physique aérobique modéré de 30 minutes par jour (bicyclette, natation, course à pied) favorise la circulation sanguine cérébrale et augmente la production des facteurs neurotrophiques comme le BDNF (brain derived neurotrophic factor) et le NGF (nerf growth factor) ce qui diminue le risque de dégénérescence des neurones et prévient contre la formation des plaques bêta amyloïdes.
3-2- Optimiser la santé du microbiote intestinal :
La dysbiose intestinale (la baisse du taux des bactéries probiotiques) dans l’intestin peut exercer un effet négatif sur le fonctionnement du système nerveux. L’hyperperméabilité intestinale ou leaky gut peut entrainer le passage des lipopolysaccharides (endotoxines bactériennes) vers le sang qui peuvent engendrer une réponse inflammatoire auto-immune et contribuer à la formation des plaques amyloïdes bêta [12]. La réparation de la muqueuse intestinale (par L-GLUTAMINE, probiotiques) et la consommation des aliments fermentés (Miso, kombucha, choucroute, légumes lactofermentés) est une stratégie efficace pour la reconstitution d’une flore intestinale saine et équilibrée.
3-3- La réduction des protéines amyloïdes bêta par les plantes :
Plusieurs plantes ont montré leur efficacité dans la réduction du taux des protéines amyloïdes bêta comme le curcuma et l’ashwaganda
- La curcumine (le principe actif continue dans le curcuma) possède des propriétés anti-inflammatoires et anti-oxydantes. Selon une étude japonaise in vitro utilisant une analyse spectroscopique de fluorescence avec de la thioflavine et une microscopie électronique, la curcumine inhibe l’agrégation des plaques amyloïdes bêta [13]. Une étude in vitro réalisée sur des macrophages et des cellules mononucléaires issues des patients atteint de la maladie d’Alzheimer a montré que la bisdemethoxycurcumine augmente la phagocytose des plaques amyloïdes bêta d’une manière efficace [14].
- L’ashwaganda est une plante médicinale asiatique adaptogène, qui appartient à la famille des Solanaceae, connue sous le nom de ginseng indien. Elle a été utilisée pendant longtemps pour traiter plusieurs pathologies dans la médecine ayurvédique. Les feuilles contiennent les wathanolides qui sont des principes actifs à propriétés pharmacologiques diverses. Il a été démontré dans une étude in vivo publiée dans le journal de plos one que l’ajout d’ashwaganda à des cellules neuronales cultivées in vitro inhibe la formation des plaques amyloïdes induitent par l’infection virale à HIV. Le test de viabilité (MTT) a montré que l’ashwganda améliore aussi la survie des neurones [15]. L’extrait méthanolique de l’ashwaganda est capable de stimuler la croissance des neurones des neuroblastomes cultivées in vitro [16].
- L’acide alpha lipoïque est une molécule antioxydante qui permet de restaurer les capacités rédox cellulaires dans les neurones. Une étude récente sur un modèle de souris a montré que le traitement par l’acide alpha lipoïque entraine une augmentation dans la phagocytose des plaques amyloïdes bêta en activant la voie de signalisation PPAR gamma et CD36 [17].
3-4- Optimiser le taux des antioxydants :
- La vitamine C est une vitamine hydrosoluble qui joue un rôle important dans l’élimination des radicaux libres. Elle permet de neutraliser l’excès de radical hydroxyle par l’activation de la réaction de fenton.
- La vitamine E est une vitamine liposoluble dont le corps a besoins pour activer le recyclage de glutathion peroxydase nécessaire pour la protection contre la peroxydation lipidique des membranes des neurones.
Plusieurs études in vivo et in vitro ont montré que la vitamine C et la vitamine E protègent contre les dommages oxydatifs de l’ADN au niveau neuronal. Une étude d’observation qui inclut 4740 participants âgés a montré que la thérapie combinée par 400 UI de vitamine E et 500 mg de vitamine C réduit la prévalence de la maladie d’Alzheimer d’une manière significative. Cependant, des donnés récentes suggèrent que des doses élevées de la vitamine E > 400 UI pendant plus que 6 ans peuvent augmenter le risque d’insuffisance cardiaque chez les patients atteint de diabète [18].
3-5- Optimiser l’oxygénation durant le sommeil :
Le syndrome d’apnée de sommeil est un trouble de ventilation nocturne qui est dû à des épisodes d’obstruction des conduits respiratoires derrière la gorge. L’académie américaine de médecine de sommeil définit le syndrome d’apnée de sommeil par une obstruction respiratoire de 30 pourcents qui dure plus de 10 secondes. Cette pathologie entraine un manque d’oxygénation cérébrale pendant le sommeil, ce qui va perturber la récupération des organes entrainant un état de fatigue générale et de somnolence durant la journée.
Le syndrome d’apnée de sommeil peut également augmenter le risque de développement des maladies cardiovasculaires, de diabète et même des maladies neurodégénératives comme l’Alzheimer. Des études récentes sur des modèles animales ont montré que l’hypoxie cérébrale contribue à la physiopathologie de la maladie d’Alzheimer. Une étude sur des souris a montré que des périodes de manque d’oxygénation cérébrale entrainent une augmentation dans le taux des plaques amyloïdes bêta [19].
Une méta-analyse récente publiée dans le journal de Sleep a montré que les problèmes de sommeil augmentent le risque de la maladie d’Alzheimer de 3.7 pourcents. Le sous-groupe de patients atteints de syndrome d’apnée de sommeil a 50 pourcents plus de risque de développer la maladie d’Alzheimer [20]. Le traitement des causes de syndrome d’apnée de sommeil comme : l’obésité, l’hypertension, les maladies auto-immunes, constitue une approche efficace pour prévenir contre le manque d’oxygénation cérébrale. L’adoption d’un régime alimentaire ancestral comme le régime paléolithique améliore le syndrome d’apnée de sommeil.
Une étude épidémiologique récente réalisée sur 9733 participants a montré que la consommation des aliments pro-inflammatoires comme : (les fritures, les boissons gazeuses sucrés et les aliments ultra-transformés) est associée à une augmentation dans le risque de développement de syndrome d’apnée de sommeil, par contre la consommation de plus de 1 fruit par jour est associée à une diminution dans le risque de développement d’Alzheimer de 26 pourcents [21].
3-6- Optimiser la fonction mitochondriale :
La maladie d’Alzheimer est souvent caractérisée par une perturbation dans la biogenèse et l’efficacité mitochondriale dans la région d’hippocampe [22]. Il est connu que l’exercice physique et le jeune contribuent au maintien de la biogenèse mitochondriale. En plus certains compléments alimentaires sont connus pour leur effet boosteur de la biogenèse et l’efficacité mitochondriale comme CoQ 10, l’acide alpha lipoïqu, N-acétyl cystéine, sélénium, le zinc, resvératrol, la vitamine C et la vitamine B1.
3-7- Augmenter l’activité des sirtuines SRT1 :
La sirtuine 1 est une enzyme nécessaire pour l’activation de la biogenèse mitochondriale et la réparation de l’ADN. Il a été démontré que la restriction calorique chez les souris permet d’activer l’expression du gène sirtuine 1 et cela a conduit à une réduction considérable dans la formation des plaques amyloïdes bêta [23]. Une étude exploratoire sur des patients atteints d’Alzheimer a montré une réduction significative dans l’expression de l’ARN de sirtuine 1 dans le cortex pariétal des patients malades [24]. Le resvératrol est un polyphénol qui appartient à la famille des stylbènes. Il a été démontré que cette molécule permet d’activer le sirtuine 1. La posologie optimale est de : 1000 mg par jour
NB : Toujours consultez votre médecin traitant avant d’adopter une cure à base de resvératrol
3-8- Soignez votre insulino résistance :
Le moyen le plus efficace pour soigner le diabète est de diminuer la consommation des carbohydrates simples (céréales raffinées) et préférer les aliments à index glycémiques bas. L’objectif à moyen terme est de réguler la glycémie : L’insuline à jeune < 7 et l’hémoglobine glyquée HBA1C < 5 (régime low carb).
Voici une liste des aliments à index glycémique bas qu’il faut privilégier :
- Céréales germées, avoine, chocolat noir à 70% de cacao.
- Farine d’orge, de pois chiche, d’amande.
- Les légumineuses (lentilles, haricots blancs).
- Fromage blanc, lait de brebis sans sucre ajouté et yaourt naturel sans sucre ajouté.
- Amandes et noix.
- Fruits frais (papaye, raisin, melon, kiwi, litchi, pastèque, banane mûre, anchois, avocat, agave, abricot sec, coin)
- Graines de chia, graines de sésame, de courge, tournesol et lin.
Tous ces aliments sont la base du régime méditerranéen qui est le nôtre.
3-9- Le cholestérol sain et l’acide gras oméga 3 sont très utiles :
Le cholestérol entre dans la composition des neurones. Il forme avec les acides gras oméga 3 la couche phospholipidique protectrice des neurones nommée la gaine de myéline qui protège les neurones contre la dégénérescence [25],[26]. En effet, 60 pourcents du poids du cerveau est formé par des lipides dont 20 pourcents sont du cholestérol. L’étude de farmingham publiée dans le journal de alzheimer disease qui porte sur 1897 participants a montré que l’augmentation du taux de cholestérol alimentaire pendant l’âge de 85 à 94 ans est associée à une réduction dans le risque de développement de déclin cognitif [27].
- Les sources de cholestérol saines à privilégier : œufs, beurres, viande rouge, formage de brebis et crème fraiche.
- Les sources de cholestérol non sain à éviter : margarine, huiles végétales transformées, huile de soja et de mais hydrogénés.
- Les sources d’acides gras oméga 3 : poisson gras, huile d’olive, graines de chia, graine de lin, graines de sésame, amandes et noix.
Références :
[1] Tiwari, S., Atluri, V., Kaushik, A., Yndart, A., & Nair, M. (2019). Alzheimer’s disease: pathogenesis, diagnostics, and therapeutics. International journal of nanomedicine, 14, 5541–5554. https://doi.org/10.2147/IJN.S200490.
[2] Role of mitochondrial amyloid-beta in Alzheimer’s disease. Chen JX, Yan SS J Alzheimers Dis. 2010; 20 Suppl 2():S569-78.
[3] Schindowski K, Belarbi K, Buée L. Neurotrophic factors in Alzheimer’s disease: role of axonal transport. Genes Brain Behav. 2008;7 Suppl 1(1):43-56. doi:10.1111/j.1601-183X.2007.00378.x.
[4] Bredesen DE, Sharlin K, Jenkins D, Okuno M, Youngberg W, et al. (2018) Reversal of Cognitive Decline: 100 Patients. J Alzheimers Dis Parkinsonism 8: 450. doi: 10.4172/2161-0460.1000450.
[5] Huang WJ, Zhang X, Chen WW. Role of oxidative stress in Alzheimer’s disease. Biomed Rep. 2016;4(5):519-522. doi:10.3892/br.2016.630.
[6] Castellani R, Hirai K, Aliev G, Drew KL, Nunomura A, Takeda A, Cash AD, Obrenovich ME, Perry G, Smith MA. Role of mitochondrial dysfunction in Alzheimer’s disease. J Neurosci Res. 2002 Nov 1;70(3):357-60. doi: 10.1002/jnr.10389. PMID: 12391597.
[7] Moreira PI, Santos MS, Seiça R, Oliveira CR. Brain mitochondrial dysfunction as a link between Alzheimer’s disease and diabetes. J Neurol Sci. 2007 Jun 15;257(1-2):206-14. doi: 10.1016/j.jns.2007.01.017. Epub 2007 Feb 20. PMID: 17316694.
[8] Valencia M, Kim SR, Jang Y, Lee SH. Neuronal Autophagy: Characteristic Features and Roles in Neuronal Pathophysiology. Biomol Ther (Seoul). 2021;29(6):605-614. doi:10.4062/biomolther.2021.012.
[9] I-Chen Li1, Han-Hsin Chang2, Chuan-Han Lin3, Wan-Ping Chen1, Tsung-Han Lu3, Li-Ya Lee1, Yu-Wen Chen1, Yen-Po Chen1, Chin-Chu Chen1,4,5,6* and David Pei-Cheng Lin3,7* Prevention of Early Alzheimer’s Disease by Erinacine A-Enriched Hericium erinaceus Mycelia Pilot Double-Blind Placebo-Controlled Study Front. Aging Neurosci., 03 June 2020 | https://doi.org/10.3389/fnagi.2020.00155.
[10] K. Barhwal, S. K. Hota, V. Jain, D. Prasad, S. B. Singh, G. Ilavazhagan, « Acetyl-L-carnitine (ALCAR) prevents hypobaric hypoxia–induced spatial memory impairment through extracellular related kinase–mediated nuclear factor erythroid 2-related factor 2 phosphorylation », Neuroscience, vol. 161, no 2, 30 juin 2009, p. 501-514.
[11] Taglialatela G, Navarra D, Cruciani R, Ramacci MT, Alemà GS, Angelucci L. Acetyl-L-carnitine treatment increases nerve growth factor levels and choline acetyltransferase activity in the central nervous system of aged rats. Exp Gerontol. 1994 Jan-Feb;29(1):55-66. doi: 10.1016/0531-5565(94)90062-0. PMID: 8187841.[12] Jiang C, Li G, Huang P, Liu Z, Zhao B. The Gut Microbiota and Alzheimer’s Disease. J Alzheimers Dis. 2017;58(1):1-15. doi: 10.3233/JAD-161141. PMID: 28372330.
[13] Ono K, Hasegawa K, Naiki H, Yamada M Curcumin has potent anti-amyloidogenic effects for Alzheimer’s beta-amyloid fibrils in vitro. J Neurosci Res. 2004 Mar 15; 75(6):742-50.
[14] Fiala, Milan et al. “Innate immunity and transcription of MGAT-III and Toll-like receptors in Alzheimer’s disease patients are improved by bisdemethoxycurcumin.” Proceedings of the National Academy of Sciences of the United States of America vol. 104,31 (2007): 12849-54. doi:10.1073/pnas.0701267104.
[15] Kurapati, Kesava Rao Venkata et al. “Ashwagandha (Withania somnifera) reverses β-amyloid1-42 induced toxicity in human neuronal cells: implications in HIV-associated neurocognitive disorders (HAND).” PloS one vol. 8,10 e77624. 16 Oct. 2013.
[16] Kuboyama T, Tohda C, Zhao J, Nakamura N, Hattori M, Komatsu K Axon- or dendrite-predominant outgrowth induced by constituents from Ashwagandha. Neuroreport. 2002 Oct 7; 13(14):1715-20.
[17] Ko Chih-Yuan, Xu Jian-Hua, Chang Yu-Wei, Lo Yangming Martin, Wu James Swi-Bea, Huang Wen-Chung, Shen Szu-Chuan TITLE=Effects of α-Lipoic Acid on Phagocytosis of Oligomeric Beta-Amyloid1–42 in BV-2 Mouse Microglial Cells JOURNAL=Frontiers in Aging Neuroscience VOLUME=13.
[18] Boothby LA, Doering PL. Vitamin C and vitamin E for Alzheimer’s disease. Ann Pharmacother. 2005 Dec;39(12):2073-80. doi: 10.1345/aph.1E495. Epub 2005 Oct 14. PMID: 16227450.
[19] Shiota S, Takekawa H, Matsumoto SE, Takeda K, Nurwidya F, Yoshioka Y, Takahashi F, Hattori N, Tabira T, Mochizuki H, Takahashi K Dis. 2013; 37(2):325-33.[20] Sleep, Cognitive impairment, and Alzheimer’s disease: A Systematic Review and Meta-Analysis. Bubu OM, Brannick M, Mortimer J, Umasabor-Bubu O, Sebastião YV, Wen Y, Schwartz S, Borenstein AR, Wu Y, Morgan D, Anderson WM Sleep. 2017 Jan 1; 40(1).
[21] Du Y, Duan X, Zheng M, Zhao W, Huang J, Lao L, Weng F, Lin DE, Yang Z, Li H, Liu X, Deng H. Association Between Eating Habits and Risk of Obstructive Sleep Apnea: A Population-Based Study. Nat Sci Sleep. 2021;13:1783-1795.
[22] Sheng B, Wang X, Su B, Lee HG, Casadesus G, Perry G, Zhu X. Impaired mitochondrial biogenesis contributes to mitochondrial dysfunction in Alzheimer’s disease. J Neurochem. 2012 Feb;120(3):419-29. doi: 10.1111/j.1471-4159.2011.07581.x. Epub 2011 Dec 8. PMID: 22077634; PMCID: PMC3253532.
[23] Qin W, Chachich M, Lane M, Roth G, Bryant M, de Cabo R, Ottinger MA, Mattison J, Ingram D, Gandy S, Pasinetti GM Calorie restriction attenuates Alzheimer’s disease type brain amyloidosis in Squirrel monkeys (Saimiri sciureus). J Alzheimers Dis. 2006 Dec; 10(4):417-22.
[24] Julien C., Tremblay C., Emond V., Lebbadi M., Salem N., Jr., Bennett D. A., et al. (2009). Sirtuin 1 reduction parallels the accumulation of tau in Alzheimer disease. J. Neuropathol. Exp. Neurol. 68, 48–58 10.1097/NEN.0b013e3181922348.
[25] Saher G, Brügger B, Lappe-Siefke C, Möbius W, Tozawa R, Wehr MC, Wieland F, Ishibashi S, Nave KA. High cholesterol level is essential for myelin membrane growth. Nat Neurosci. 2005 Apr;8(4):468-75. doi: 10.1038/nn1426. Epub 2005 Mar 27. PMID: 15793579.
[26]Pu H, Guo Y, Zhang W, Huang L, Wang G, Liou AK, Zhang J, Zhang P, Leak RK, Wang Y, Chen J, Gao Y. Omega-3 polyunsaturated fatty acid supplementation improves neurologic recovery and attenuates white matter injury after [26 [26 experimental traumatic brain injury. J Cereb Blood Flow Metab. 2013 Sep;33(9):1474-84. doi: 10.1038/jcbfm.2013.108. Epub 2013 Jun 26. PMID: 23801244; PMCID: PMC3764381.
[27] Jeremy M. Silverman,James Schmeidler https://doi.org/10.1016/j.jalz.2018.01.009 Citations: 1 Outcome age-based prediction of successful cognitive aging by total cholesterol First published: 04 March 2018.