Objectifs:
- Illustrer le rôle du microbiote intestinal dans le fonctionnement de système nerveux.
- Mettre l’accent sur le rôle des probiotiques et des prébiotiques dans les troubles neuropsychiatriques.
Sommaire
1- Introduction au microbiote intestinale et au concept de l’axe intestin-cerveau
3- Rôle de microbiote intestinal dans la production des neurotransmetteurs
4- Rôle des post biotiques et des produits intermédiaires du microbiote sur la santé
5- Rôle de microbiote intestinale dans le maintien de la fonction immunitaire
6- Les bienfaits des probiotiques et des prébiotiques dans les troubles neuropsychiatriques
7-Le rôle de certains nutriments dans l’axe intestin cerveau
- Les acides gras oméga 3
- Les aliments fermentés
- Les aliments riches en polyphénols
- Les aliments riches en tryptophanes
1- Introduction au microbiote intestinale et au concept de l’axe intestin-cerveau
Le tractus gastro-intestinal constitue la plus grande surface du corps humain (250–400) m2 et il est colonisé par plus 1014 cellules et de plus de 1000 espèces bactériennes impliquées dans l’absorption des minéraux, le contrôle de la multiplication d’autres bactéries pathogènes ainsi que le maintien de la structure et la perméabilité intestinale. Le microbiote intestinal est principalement constitué de quatre phylums (Firmicutes, Bacteroidetes, Actinobacteria et Proteobacteria)[1]. Il est estimé que le nombre de cellules bactériennes dans le tractus gastro-intestinal est équivalent au nombre de cellules humaines. Ce qui prouve que notre microbiote participe à plusieurs réactions métaboliques que nous ne pouvons pas l’accomplir tout seul comme la digestion des polysaccharides[2]. Ces bactéries sont capables de transférer entre eux des gènes par recombinaison homologue. Ces gènes ont plusieurs fonctions, ils peuvent être des gènes de résistances aux antibiotiques [3] ou des gènes ayant d’autres fonctions métaboliques et énergétiques. La compétition des bactéries envers les nutriments et les substrats énergétiques va favoriser une pression de sélection qui va favoriser l’émergence de certains types de bactéries qui vont accomplir l’homéostasie et empêcher la multiplication des souches pathogènes impliquées dans la physiopathologie de plusieurs maladies chroniques comme le diabète, le syndrome métabolique, les maladies neurodégénératives et neuropsychiatriques. Le développement de la microflore intestinale commence à la naissance, plusieurs études ont souligné que le développement précoce du microbiote intestinal du nourrisson joue un rôle important dans la maturation du système immunitaire, la protection contre les agents pathogènes, et l’absorption des nutriments (minéraux et vitamines).
Certaines bactéries probiotiques comme Akkermansia Muciniphila jouent un rôle crucial dans le métabolisme énergétique, le fonctionnement de système nerveux et immunitaire [4], pas seulement ça le microbiote intestinale peut contrôler notre niveau d’inflammation qui est une composante impliquée dans la physiopathologie de plusieurs maladies. Il a été démontré dans une étude clinique randomisée publiée dans le journal de Nutrition que la consommation des probiotiques contenant bifidobacterium lactis permet de diminuer le taux de cholestérol, triglycérides et les marqueurs inflammatoires comme (IFN gamma, IL 6) [5]. Les bactéries probiotiques peuvent influencer notre physiologie par la production des produits intermédiaires appelé post biotique, l’exemple le plus concret de ces molécules sont les acides gras de chaîne courte (SCFA, l’acide butyrique, l’acide propionique, l’acide acétique) qui sont impliqués dans l’homéostasie énergétique. Par l’intermédiaire de ces effets bénéfiques, les bactéries pro biotiques de notre microbiote intestinal peuvent contrôler le fonctionnement de notre cerveau par plusieurs mécanismes complexes :
- Le contrôle de l’inflammation,
- La production de neurotransmetteurs,
- La production des acides gras à chaîne courte,
- La stimulation du nerf vague .
Ce concept est appelé l’axe intestin cerveau ( Gut brain axis ) .C’est la relation entre l’état et la diversité de notre microbiote intestinal et le fonctionnement de notre système nerveux .
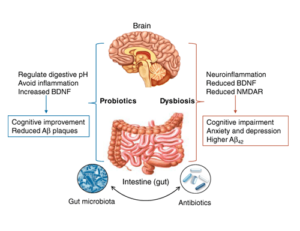
La dysbiose intestinale qui est l’altération de la diversité de notre microbiote intestinal et la baisse du taux de bactéries probiotiques peut affecter notre cerveau de plusieurs manières. L’utilisation abusive et non contrôlé des antibiotiques engendre une dysbiose intestinale qui induit un état de neuro-inflammation et une baisse dans la production des facteurs neurotrophiques comme le BDNF (brain derived neurotrophic factor) ce qui augmente le risque de déclin cognitif et l’apparition des maladies neuro psychiatriques comme la dépression et l’anxiété (ce processus est illustré dans le schéma ci-dessous)[6].
2- Le rôle du nerf vague
Il existe environ 100 milliards de neurones dans le cerveau humain et 500 millions dans notre intestin. Le nerf Vague (appelé aussi pneumogastrique ou parasympathique) et l’un des plus gros nerfs qui relient l’intestin à notre cerveau. Le vague naît dans le bulbe rachidien, puis il chemine dans le cou, à travers le médiastin et se termine au niveau du thorax et de l’abdomen, il joue un rôle crucial dans la contraction du cœur, la régulation de la pression artérielle, dans la sécrétion des glandes surrénales. Ce nerf est capable de transmettre des messages nerveux de l’intestin vers le cerveau et dans le sens contraire.
Des études ont montré que ce nerf joue un rôle important dans la satiété, et dans la réponse au stress.
Ce nerf est capable de détecter les métabolites du microbiote à travers ses afférences, de transférer ces informations vers le système nerveux central où elles sont intégrées dans le réseau autonome central. Les nutriments ingérés peuvent aussi influencer le nerf vague, après ingestion des glucides complexes et des protéines, les cellules entéro-endocrines par exemple sécrètent la sérotonine qui va activer les récepteurs HT3 au niveau du nerf vague. L’interaction entre le nerf vague et notre microbiote intestinale a été décrite dans plusieurs études scientifiques qui ont montré que ce dernier est capable d’activer une réponse anti-inflammatoire cholinergique, qui est capable d’atténuer l’inflammation périphérique et de diminuer la perméabilité intestinale, modulant aussi la composition du microbiote[7].
Il est connu que le stress inhibe le nerf vague et exerce des effets délétères sur le tractus gastro-intestinal et sur le microbiote[7]. Certaines pathologies comme le syndrome d’intestin irritable et la colopathie fonctionnelle sont corrélées avec un dysfonctionnement du nerf vague[8].
3- Rôle de microbiote intestinal dans la production des neurotransmetteurs
Savez-vous que notre microbiote intestinal est capable de produire et de moduler la production des neurotransmetteurs qui régulent notre humeur et nos émotions. La sérotonine par exemple est produite à 95 pourcent par les cellules entérochromaffines qui est influencée profondément par la diversité de notre microbiote intestinal [9]. La sérotonine intestinale exerce un rôle important dans la régulation de la motilité intestinale ainsi que dans le métabolisme osseux.
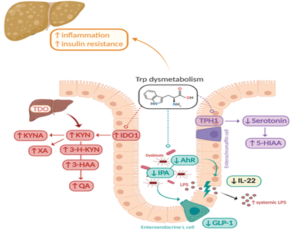
Il faut noter que la sérotonine intestinale ne passe pas la barrière hémato-encéphalique. Mais l’état de notre microbiote peut influencer profondément la sérotonine cérébrale. La dysbiose intestinale entraîne un déclenchement de l’inflammation accompagné par une altération de la réparation de la muqueuse intestinale par le GLP 1 et la production de plusieurs métabolites dérivé de kynurenine comme kynurenic acid (KYNA), xanthurenic acid (XA), 3-hydroxykynurenine. Chez les personnes souffrant de troubles neuropsychiatriques. Ce processus entraîne une diminution de la biodisponibilité de 5 hydroxy tryptophane dans le cerveau et par conséquence une diminution dans la production de la sérotonine cérébrale. Ci-joint un schéma qui résume le métabolisme du tryptophane en cas de dysbiose[16].
L’acide gamma-amino butyrique par exemple est un neurotransmetteur impliqué dans le contrôle du stress et de sommeil qui est produit par les bactéries probiotiques (en particulier lactobacillus) du microbiote intestinal [10,11].
La dopamine est le neurotransmetteur impliqué dans la motricité, la contraction musculaire, l’excitation et la motivation, la mémoire et la concentration. Ce dernier est produit à 50 pourcent par les intestins. L’émergence des bactéries pathogènes comme(Klebsiella pneumoniae, Pseudomonas aeruginosa) dans le contexte de la dysbiose intestinale entraîne une réduction significative dans la production de dopamine[12]. La sérotonine intestinale ne passe pas la barrière hémato méningée. La sérotonine intestinale intervient dans la régulation du métabolisme osseux.
4- Rôle des post biotiques et des produits intermédiaires du microbiote sur la santé
Plusieurs produits intermédiaires sont produits par notre microbiote intestinal, en particulier les acides gras à chaîne courte (SCFA) : butyrate, propionate, acide acétique, qui sont importants pour le maintien de l’intégrité de la barrière intestinale ainsi que le maintien de l’acidité qui nous protège contre l’émergence des souches pathogènes[13]. Ces SCFA sont produits particulièrement après la dégradation des fibres alimentaires par ces bactéries probiotiques, chaque type de bactérie possède une source de carbone préférable. Par exemple, le bifidobactérium utilise l’inuline pour produire des acides gras à chaîne courte. C’est pourquoi que la diversité en fibre est importante pour optimiser la production des post biotiques. Certaines bactéries sont en interaction constante et elles ne sont capables d’utiliser certains substrats qu’en cas d’association avec d’autres types de bactéries Roseburia sp Par exemple, n’est capable d’utiliser le lactate et produire de butyrate que lorsque B. adolescentis est présente dans un milieu contenant les fructooligosaccharides FOS [14].
Les bactéries intestinales sont aussi capables de métaboliser les acides aminés et les sels biliaires pour produire d’autres molécules qui peuvent affecter notre cerveau et nos émotions[15].
Ci-joint un tableau qui résume les sous métabolites produits par notre microbiote intestinal et leur rôle dans le corps et le système nerveux [16 ]:
|
Sous métabolite bénéfique |
Espèces Bactériennes productrices |
Rôle dans le système nerveux |
|
Acétate |
Bacteroides, Bifidobacterium, Clostridium, Ruminococcus |
Métabolisme énergétique (production d’acétyl coA) |
|
Butyrate |
Faecalibacterium, Eubacterium and Roseburia |
Signalisation cellulaire et un rôle anti-inflammatoire |
|
Propionate |
Prevotella, Alistipes, Ruminococcus, Phascolarctobacterium, Dialister, Akkermansia |
Signalisation cellulaire |
|
Neurotransmetteurs :GABA , dopamine, sérotonine |
– |
Transmission de l’influx nerveux, régulation de l’humeur, des émotions, du comportement |
|
Dérivé indolique de tryptophane |
– |
Régulation des récepteurs AHR |
|
H2S |
Escherichia, Salmonella, Enterobacter, |
Donneur d’électron |
|
Oxide nitrique |
–Bacillus subtilis |
Vasodilatation artérielle |
|
Sulfites, cystéine, taurine |
– |
Rôle métabolique |
|
Acide linoléique conjugué |
– |
Lipolyse et régulation du métabolisme énergétique Modulation du système immunitaire |
D’autres métabolites nocifs sont produits en cas de dysbiose intestinale comme les lipopolysaccharides LPS , le triméthylamine qui est par la suite oxydé dans le foie pour former le TMAO et les endotoxines qui peuvent entraîner une hyperperméabilité intestinale et une hyper activation du système immunitaire associé à une inflammation chronique.
5- Rôle de microbiote intestinale dans le maintien de la fonction immunitaire
La fonction principale du système immunitaire intestinal est de contrôler la multiplication des souches pathogènes. La littérature scientifique récente montre que la composition et la diversité bactérienne influencent les réponses immunitaires innées et adaptatives. En cas d’altération de cette diversité bactérienne un état inflammatoire peut s’installer et cela conduit à l’affaiblissement du système immunitaire[17].
Certaines bactéries du microbiote intestinal transmettent des signaux qui affectent les fonctions du système immunitaire inné et adaptatif, par exemple l’augmentation de nombre des bactéries filamenteuses segmentées (SFB) est associée à l’augmentation de nombre de lymphocytes T auxiliaires 17 (TH17) dans l’intestin grêle [18]. Une étude a montré que quelques espèces de Bifidobacterium peuvent augmenter l’effet antitumoral en augmentant le nombre de lymphocytes T [19]. Cette augmentation du nombre de lymphocytes T induite par ces bactéries exerce des propriétés anti-inflammatoires. Certaines bactéries du microbiote peuvent activer les cellules TH17 et par conséquence augmenter leurs productions de cytokines, l’interleukine (IL) -17A, IL-17 F et l’IL-22, qui stimulent la production de protéines antimicrobiennes par les cellules épithéliales intestinales ainsi que la formation de jonctions serrées entre ces cellules[20]. Ce type de lymphocytes est très important dans la prévention contre la dysbiose par le contrôle de la multiplication des souches pathogènes.
On sait que l’inflammation est une composante importante dans la physiopathologie des maladies neuropsychiatrique et que certains troubles comme la dépression et la schizophrénie sont souvent accompagnés d’une perturbation de l’axe intestin cerveau qui se manifeste par des souches bactériennes anormales, une inflammation dans la muqueuse intestinale et un dérèglement de système immunitaire [21].
6- Les bienfaits des probiotiques et des prébiotiques dans les troubles neuropsychiatriques
Plusieurs stratégies ont été décrites dans la littérature qui aide à augmenter le taux de bactéries probiotiques dans l’intestin pour diminuer les symptômes de dépression et de l’anxiété. Selon une étude clinique publiée dans le journal de Frontiers in Psychiatry et qui porte sur des patients atteints de dépression, les résultats ont montré que la prise de complément alimentaire de probiotique qui contient Lactobacillus helveticus R0052, Bifidobacterium longum améliore les symptômes dépressifs et la qualité de sommeil d’une manière significative[22]. Un Review publié dans le journal Annals of psychiatry et qui résume plusieurs études cliniques et méta-analyse conclut que les probiotiques constituent un outil très efficace dans le traitement des symptômes dépressifs [23]. Selon une autre méta-analyse publiée dans le journal Frontiers in neurology et qui résume 10 études cliniques randomisées qui portent sur des patients âgés plus que 16 ans et qui souffrent d’anxiété et de dépression. Les résultats montrent que le traitement avec les probiotiques diminue les scores de dépression par rapport au placébo, concernant l’anxiété les résultats n’ont pas montré une différence significative [24].
Selon un article publié dans le Journal of pharmacy and bioallied science. Les personnes qui souffrent de troubles psychotiques et schizophréniques souffrent souvent de dysbiose intestinale et d’intolérances alimentaires qui peuvent être corrigées par la prise des probiotiques[25].
Les prébiotiques sont des glucides et des fibres indigestes qui sont fermenté par les bactéries intestinales, ils stimulent la multiplication des probiotiques en leur fournissant des substrats énergétiques sélectifs pour les différents phylums du microbiote. L’association d’un probiotique et d’un prébiotique dans un supplément porte le nom de symbiotique. Les prébiotiques le plus fréquemment sont l’oligofructose, l’inuline qui appartient aux fructanes, les galacto-oligosaccharides, les trans-galactooligosaccharides, les xylooligosaccharides, le lactulose et les oligosaccharides. Une fois fermentée les prébiotiques sert à diminuer le PH intestinal par la stimulation de la production des acides gras à chaînes courtes par les probiotiques ce qui forme un environnement difficile pour la multiplication des bactéries pathogène qui ne supportent pas cette acidité.
Les prébiotiques se trouvent dans les fruits, les légumes, les céréales et d’autres plantes comestibles. On peut citer comme sources : les tomates, artichauts, bananes, asperges, baies, ail, oignons, chicorée, légumes verts, légumineuses, ainsi sous forme d’avoine, de lin, d’orge. La conclusion avoir une alimentation diverse riche en prébiotique contribue à la diversité de votre microbiote intestinal !
7- Le rôle de certains nutriments dans l’axe intestin cerveau
Plusieurs nutriments ( vitamines et sels minéraux et acides gras essentiels ) et aliments jouent un rôle important dans le maintien de la santé du microbiote intestinale :
Qui se trouvent essentiellement dans les poissons gras ( sardine , saumon , etc..) sont bénéfiques pour notre , microbiote .Ils entrent dans la composition des gaines de myéline : la membrane qui protège les neurones de cerveau contre les maladies neurodégénératives plusieurs études ont montré que la prise de complément d’acides gras oméga 3 permet de diminuer les symptômes de troubles neuropsychiatriques [26] , [27] .
Comme le Miso , le vinaigre de kombucha , la choucroute , le kimchi , le Nato , les légumes lacto fermentées , le kéfir sont riches en probiotiques ce qui exerce des effets bénéfiques sur la flore intestinale . Une étude publiée dans le journal de gastroentérologie a montré que la consommation du lait fermenté module l’activité du cerveau à travers la communication entre les entérochromaffines et le nerf vague [28].
-
Les aliments riches en polyphénols :
La consommation des aliments riches en polyphénols comme le thé vert, le cacao, l’huile d’olive contribue à la diversité de microbiote intestinal ce qui améliore la cognition [29].
-
Les aliments riches en tryptophanes :
Il a été démontré que les aliments riches en tryptophanes viandes et volailles, produits laitiers, œufs et poisson. Légumineuses et oléagineux améliorent l’interaction entre l’intestin et le cerveau par l’intermédiaire de la production de la sérotonine [30].
Références
[1] Hills, R.D.; Pontefract, B.A.; Mishcon, H.R.; Black, C.A.; Sutton, S.C.; Theberge, C.R. Gut Microbiome: Profound Implications for Diet and Disease. Nutrients 2019, 11, 1613. https://doi.org/10.3390/nu1107161
[2] Backhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI (2005) Hostbacterial mutualism in the human intestine. Science 307: 1915–1920.
[3] Salyers AA, Gupta A, Wang Y (2004) Human intestinal bacteria as reservoirs for antibiotic resistance genes. Trends Microbiol 12: 412–416.
[4] yu, xu & Wang, Ning & Tan, Hor-Yue & Li, Sha & Zhang, Cheng & Feng, Yibin. (2020). Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Frontiers in Microbiology. 11. 10.3389/fmicb.2020.00219.
[5] Bernini LJ, Simão AN, Alfieri DF, Lozovoy MA, Mari NL, de Souza CH, Dichi I, Costa GN. Beneficial effects of Bifidobacterium lactis on lipid profile and cytokines in patients with metabolic syndrome: A randomized trial. Effects of probiotics on metabolic syndrome. Nutrition. 2016 Jun;32(6):716-9. doi: 10.1016/j.nut.2015.11.001. Epub 2015 Dec 7. PMID: 27126957.
[6] Angelucci, Francesco & Cechova, Katerina & Amlerova, Jana & Hort, Jakub. (2019). Antibiotics, gut microbiota, and Alzheimer’s disease. Journal of Neuroinflammation. 16. 10.1186/s12974-019-1494-4.
[7] Bruno Bonaz1,2*, Thomas Bazin3,4 and Sonia Pellissier5The Vagus Nerve at the Interface of the
Microbiota-Gut-Brain Axis MINI REVIEW article Front. Neurosci., 07 February 2018, https://doi.org/10.3389/fnins.2018.00049.
[8] Sonia Pellissier 1, Cécile Dantzer 2, Laurie Mondillon 3, Candice Trocme 4, Anne-Sophie Gauchez 4, Véronique Ducros 4, Nicolas Mathieu 5, Bertrand Toussaint 6, Alicia Fournier 3, Frédéric Canini 7, Bruno Bonaz 8 Relationship between vagal tone, cortisol, TNF-alpha, epinephrine and negative affects in Crohn’s disease and irritable bowel syndrome PLoS One . 2014 Sep 10;9(9):e105328. doi: 10.1371/journal.pone.0105328. eCollection 2014.
[9] Jessica M. Yano1, Kristie Yu1, Gregory P. Donaldson1, Gauri G. Shastri1, Phoebe Ann1, Liang Ma2, Cathryn R. Nagler3, Rustem F. Ismagilov2, Sarkis K. Mazmanian1, and Elaine Y. Hsiao1 Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis Cell. 2015 April 9; 161(2): 264–276. doi:10.1016/j.cell.2015.02.047.
[10] Roberto Mazzoli* and Enrica Pessione The Neuro-endocrinological Role of Microbial Glutamate and GABA Signaling Front. Microbiol., 30 November 2016 | https://doi.org/10.3389/fmicb.2016.01934.
[11] Rafal Janik 1, Lynsie A M Thomason 2, Andrew M Stanisz 3, Paul Forsythe 4, John Bienenstock 5, Greg J Stanisz 6 Magnetic resonance spectroscopy reveals oral Lactobacillus promotion of increases in brain GABA, N-acetyl aspartate and glutamate Neuroimage . 2016 Jan 15;125:988-995. doi: 10.1016/j.neuroimage.2015.11.018. Epub 2015 Nov 11.
[12] Neurotransmitter modulation by the gut microbiota Philip Strandwitza aAntimicrobial Discovery Center, Department of Biology, Northeastern University, 134 Mugar Hall, 360 Huntington Avenue, Boston, MA, USA Brain Res. 2018 August 15; 1693(Pt B): 128–133. doi:10.1016/j.brainres.2018.03.015.
[13] David Ríos-Covián, Patricia Ruas-Madiedo, Abelardo Margolles, Miguel Gueimonde, Clara G. de los Reyes-Gavilán and Nuria SalazarIntestinal Short Chain Fatty Acids and their Link with Diet and Human Health Front. Microbiol., 17 February 2016 | https://doi.org/10.3389/fmicb.2016.00185.
[14] Belenguer, A., Duncan, S. H., Calder, A. G., Holtrop, G., Louis, P., Lobley, G. E., et al. (2006). Two routes of metabolic cross-feeding between Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut. Appl. Environ. Microbiol. 72, 3593–3599. doi: 10.1128/AEM.72.5.3593-3599.2006.
[15] Gerard Clarke, Roman M. Stilling, […], and Timothy G. Dinan Minireview: Gut Microbiota: The Neglected Endocrine Organ molecular endocrinology journal 2014 aug 28(8).
[16] Agus A, Clément K, Sokol H Gut microbiota-derived metabolites as central regulators in metabolic disorders Gut 2021;70:1174-1182.
[17] West CE. Gut microbiota and allergic disease: new findings. Curr Opin Clin Nutr Metab Care. 2014;17(3):261–6.
[18] Ivanov, I. I. et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 139, 485–498 (2009).
[19] Sivan, A. et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science 350, 1084–1089 (2015).
[20] Honda, K., & Littman, D. R. (2016). The microbiota in adaptive immune homeostasis and disease. Nature, 535(7610), 75–84. doi:10.1038/nature18848.
[21] Marta Grochowska 1, Marcin Wojnar 2, Marek Radkowski 3 The gut microbiota in neuropsychiatric disorders Acta Neurobiol Exp (Wars) . 2018;78(2):69-81.
[22] Caroline J. K. Wallace1* and Roumen V. Milev1,2 The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study ORIGINAL RESEARCH article Front. Psychiatry, 15 February 2021 | https://doi.org/10.3389/fpsyt.2021.618279.
[23] Wallace, C.J.K., Milev, R. The effects of probiotics on depressive symptoms in humans: a systematic review. Ann Gen Psychiatry 16, 14 (2017). https://doi.org/10.1186/s12991-017-0138-2.
[24] Chao Limin, Liu Cui, Sutthawongwadee Senawin, Li Yuefei, Lv Weijie, Chen Wenqian, Yu Linzeng, Zhou Jiahao, Guo Ao, Li Zengquan, Guo ShiningEffects of Probiotics on Depressive or Anxiety Variables in Healthy Participants Under Stress Conditions or With a Depressive or Anxiety Diagnosis: A Meta-Analysis of Randomized Controlled Trials JOURNAL=Frontiers in Neurology VOLUME=11 YEAR=2020421 URL=https://www.frontiersin.org/article/10.3389/fneur.2020.00421
[25] Sandeep Grover,1 Amol Patil,2 Anit Kaur,3 and Gaurav Garg2 Probiotics: A Potential Immunotherapeutic Approach for the Treatment of Schizophrenia J Pharm Bioallied Sci. 2019 Oct-Dec; 11(4): 321–327.doi: 10.4103/jpbs.JPBS_47_19.
[26] Cristina Menni,1 Jonas Zierer,1,2 Tess Pallister,1 Matthew A. Jackson,1 Tao Long,3 Robert P. Mohney,4 Claire J. Steves,1 Tim D. Spector,1 and Ana M. Valdes1,5,6 Omega-3 fatty acids correlate with gut microbiome diversity and production of N-carbamylglutamate in middle aged and elderly women Sci Rep. 2017; 7: 11079. Published online 2017 Sep 11. doi: 10.1038/s41598-017-10382-2.
[27] R J T Mocking, I Harmsen, […], and A H Schene Meta-analysis and meta-regression of omega-3 polyunsaturated fatty acid supplementation for major depressive disorder Transl Psychiatry. 2016 Mar; 6(3): e756. Published online 2016 Mar 15. doi: 10.1038/tp.2016.29.
[28] KIRSTEN TILLISCH, JENNIFER LABUS, […], and EMERAN A. MAYER Consumption of Fermented Milk Product With Probiotic Modulates Brain Activity of Gastroenterology at www.gastrojournal.org, and at http://dx.doi:10.1053/j.gastro.2013.02.043.
[29] Amit Kumar Singh, Célia Cabral, […], and Abhay K. Pandey Beneficial Effects of Dietary Polyphenols on Gut Microbiota and Strategies to Improve Delivery Efficiency Nutrients. 2019 Sep; 11(9): 2216. Published online 2019 Sep 13. doi: 10.3390/nu11092216.