Sommaire :
1- La sarcopénie : définition :
La sarcopénie est définie par une perte de la masse et de la force musculaire qui apparaît généralement avec le vieillissement (après 50 ans). Ce trouble grave entraîne chez les personnes âgées, une fragilité, des difficultés dans la marche et une réduction dans les capacités d’effectuer des tâches quotidiennes et une baisse des performances physiques. Il est connu que les personnes sédentaires (inactives) perdent de 3 à 5 pourcent de leur masse musculaire après l’âge de 30 ans. La sarcopénie commence à s’accélérer généralement après l’âge de 75 ans et constitue un facteur de risque majeur pour les fractures de l’OS comme les fractures du col de fémur [1]. La sarcopénie est aussi associée à une augmentation dans la taille du tissu adipeux viscérale qui augmente le risque de développement de syndrome métabolique et de maladies cardiovasculaires.
Il est estimé selon les études épidémiologiques réalisées aux États Unies que la sarcopénie touche 10 pour cent des hommes et 8 pourcent des femmes âgées entre 60 et 69 ans et elle touche 40 pourcent des hommes et 18 pourcent des femmes âgés plus que 80 ans [2].
2- Les causes et la physiopathologie de la sarcopénie [3] :
Le tissu musculaire est formé par 2 types de fibres :
Les fibres musculaires de type 1 (fibres rouges à contraction lente) qui se caractérisent par une grande densité mitochondriale. Ils sont également résistants à la fatigue. Ils sont utiles pour les exercices puissants d’endurance.
Les fibres musculaires de type 2 (fibres blanches à contraction rapide). Ce sont des fibres pauvres, en mitochondries peu vascularisées. Ils interviennent dans la contraction bref et rapide. Avec l’âge, l’atrophie musculaire touche essentiellement les fibres de type 2 [4].
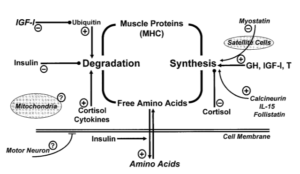
La physiopathologie de la sarcopénie implique plusieurs mécanismes biologiques complexes qui sont initiés par des processus neurodégénératifs et des perturbations métaboliques et hormonales, les processus suivants sont les plus impliqués et les plus décrites dans la littérature :
- Une réduction dans la signalisation nerveuse du cerveau vers les muscles
- Une baisse dans le taux des hormones qui supportent la croissance musculaire (testostérone, insulin like growth factor, hormone de croissance, GH).
- Une augmentation dans le taux d’hormones de stress (cortisol) qui stimule le catabolisme musculaire.
- Une diminution de l’utilisation cellulaire de protéines et une augmentation de la protéolyse et l’ubiquitination.
- L’insulino résistance qui peut induire une diminution dans l’activité de l’oxyde nitrique synthase nécessaire pour l’utilisation cellulaire des acides aminés.
- L’augmentation de l’expression de la myostatine stimule le catabolisme musculaire et entraîne une réduction dans le taux de fibres et unités motrices musculaires.
- La carence en protéines et en acides aminées essentiels.
- L’augmentation du statut inflammatoire dans l’organisme, une inflammation de bas grade qui entraine une augmentation dans la production de cytokines (IL6, et TNF alpha, protéine C réactive).
- Le dysfonctionnement mitochondrial.
Schémas expliquant les différentes signalisations endocriniennes impliquées dans l’initiation de la sarcopénie [3].
3- Des moyens Naturels pour combattre la sarcopénie :
3-1. La place de l’exercice de résistance musculaire :
Ce qui est sûr que l’exercice physique constitue l’approche numéro 1 pour la prévention de la sarcopénie et la perte de la fonction et l’endurance musculaire. L’organisation mondiale de la santé recommande l’adoption d’un programme d’exercice physique aérobique de 150 minutes par semaine et 2 séances d’exercice de résistance musculaire par semaine. Ce dernier permet d’augmenter la croissance, l’endurance et la force musculaire. L’exercice aérobique en particulier permet de stimuler la biogenèse mitochondriale dans les fibres musculaires ce qui permet de prévenir aussi contre les troubles métaboliques (diabète, obésité, syndrome métabolique).
L’association Américaine de sarcopénie recommande l’adoption de 20 à 30 minutes d’exercice physique aérobique pour les personnes âgées et 30 minutes d’exercice de résistance musculaire 3 fois par semaine [5].
Une étude clinique randomisée a exploré l’effet de la supplémentation avec un antioxydant (la catéchine) associé à un exercice physique sur la masse et la puissance musculaire chez des femmes sarcopéniques âgées de 75 ans. Les participants de l’étude ont été subdivisés en 4 groupes : 32 ont pratiqué l’exercice physique associé à la prise de 350 ml de thé vert (contenant la catéchine), 32 ont consommé le thé (catéchine) seulement. 32 ont pratiqué l’exercice physique uniquement et un groupe contrôle. Les résultats ont montré que la combinaison de l’exercice et la prise de la catéchine a entraîné une augmentation significative dans la masse musculaire et a amélioré les capacités physiques mesurées par le test de la marche rapide (p=0.007) [6].
3-2. L’augmentation de l’apport en protéines de qualité :
Plusieurs études scientifiques ont mis l’accent sur l’importance d’avoir un apport optimal en protéines pour stimuler la croissance musculaire. Surtout chez les personnes âgées qui présentent une diminution dans l’absorption des acides aminés au niveau intestinal ainsi qu’une diminution dans leur utilisation cellulaire. Les recommandations actuelles de 0.8 g/ kg de poids corporel sont insuffisantes pour prévenir la sarcopénie.
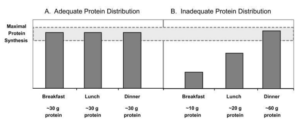
La société européenne de nutrition clinique (Européen society of clinical Nutrition and metabolism) recommande aux adultes en bonne santé de satisfaire les besoins de 1.2 g/kg de protéines par jour. Pour les personnes souffrant de sarcopénie ou de maladies chroniques. L’apport optimal est de 1.5 g/kg. Pour un individu de 80 KG par exemple, il est conseillé de satisfaire les besoins de 120 g de protéines par jour [7]. Des études suggèrent que la répartition des protéines tout au long de la journée est essentielle, une étude publiée dans current opinion in clinical nutrition and metabolism met l’accent sur la nécessité d’avoir un apport de 25 à 30 grammes de protéines de qualité pour chaque repas pour stimuler la synthèse musculaire chez les adultes. Si la quantité de protéines est inadéquate (<20 grammes) pour une raison ou une autre. L’ingestion de complément alimentaire de protéines contenant la leucine pourrait avoir un effet bénéfique et compensatoire [8].
La répartition des protéines entre les repas en quantité égale est importante pour avoir un effet anabolique.
- Les sources de protéines de qualité :
|
Source de protéine |
Taux d’utilisation par le corps |
|
Œufs |
94 |
|
Whey protéine (extrait à partir du lait) |
92 |
|
Lait |
82 |
|
Bœuf |
73 |
|
Gluten de blé |
67 |
|
Soja |
61 |
- La teneur en protéine de certains aliments :
|
Source de protéine |
Teneur en protéine g/100 g |
|
Oeuf |
13 grammes |
|
Bœuf |
26 grammes |
|
Lait |
3.4 grammes |
|
Yaourt |
10 grammes |
|
Fromage blanc |
11 grammes |
|
Poisson (saumon) |
22 grammes |
|
Poulet |
27 grammes |
|
Dinde |
29 grammes |
|
Haricots |
6 grammes |
|
Lentille |
9 grammes |
|
Pois chiche |
19 grammes |
|
Pain de blé |
9 grammes |
3-3. L’augmentation des apports d’acides gras oméga 3 :
Il a été démontré que les acides gras oméga 3 influencent le métabolisme des protéines à l’échelle intracellulaire et affectent la croissance musculaire en agissant sur la physiologie mitochondriale. Une étude clinique randomisée publiée dans Amercian journal of clinical Nutrition a comparé l’effet de la consommation des acides gras oméga 3 à l’huile de maïs pendant 8 semaines sur la synthèse des protéines au niveau des muscles chez 16 adultes. Les résultats ont montré que la prise des acides gras oméga 3 entraîne une augmentation plus importante dans la synthèse musculaire chez les adultes. Ces effets ont été mesurés par une augmentation de l’expression de la Protéine Mtor et le facteur p70s6k (impliqués dans la synthèse des protéines à l’intérieur de la cellule) [9].
Une autre étude clinique randomisée publiée dans le même journal qui porte sur 44 adultes âgés entre 60 et 85 ans a montré que la consommation d’huile de poisson(source d’acides gras oméga 3) a permis d’augmenter le volume musculaire et la puissance cinétique musculaire [10]. Les auteurs ont conclu que la prise d’acides gras oméga 3 constitue une approche efficace pour prévenir la sarcopénie.
Une revue publiée dans le journal Aging clinical and experimental research a montré que les acides gras oméga 3 permettent de ralentir le processus de inflammaging (c’est l’inflammation de bas grade associé au vieillissement) et l’immunosénescence (dysfonctionnement des cellules immunitaires associé à l’âge). Ces effets anti-inflammatoires des acides gras oméga 3 permettent d’inhiber l’ubiquitination et la protéolyse qui sont deux processus impliqués dans le catabolisme musculaire [11]. Les auteurs ont montré que les acides gras oméga 3 permettent de stimuler la protéine Mtor et par conséquent augmentent la synthèse intracellulaire des protéines.
Il a été démontré que la consommation des acides gras oméga 3 sous forme de 3 g d’huile de poisson combiné avec un programme d’exercice musculaire de résistance permet d’augmenter la masse musculaire et l’endurance musculaire chez 23 femmes adultes [12].
- Les sources d’acides gras oméga 3 :
Pour l’EPA (acide eicosapentaénoïque) et DHA (L’acide docosahexaénoïque) : ils sont présents essentiellement dans les produits animaux : poissons gras : (sardines, saumon, maquereaux, Herring) et huile de foie de Morue et dans les œufs.
Pour l’acide alpha linolénique (ALA) : il est présent essentiellement dans l’huile d’olive, l’huile de noix et de lin, les graines de sésames et les graines de chia.
3-4. Optimiser les hormones en assurant un apport adéquat en acides gras essentiels :
Les hormones (GH et testostérone) jouent un rôle important dans la croissance musculaire. Plusieurs études chez les humains ont montré que l’apport en lipides et en cholestérol est un facteur qui influence la sécrétion et le métabolisme des androgènes [13] . En effet, nos hormones stéroïdiennes testostérone pour l’homme) (œstrogène et progestérone) pour la femme sont fabriqué à partir de cholestérol. Bien qu’il soit dénigré, le cholestérol est un composé essentiel pour le bon fonctionnement de nos cellules. Le cholestérol non oxydé présent dans les aliments naturels comme : (le beurre, le lait entier, le poisson, les œufs et la viande issue d’élevage naturel) est tout à fait sécuritaire. Par contre, le cholestérol oxydé présent dans les huiles hydrogénées et la margarine posent des risques majeurs pour la santé cardiovasculaire chez les humains.
Une étude clinique publiée dans le journal de steroide biochemestry a comparé l’adoption d’un régime alimentaire riche en lipides de sources animales (40 pour cent de l’apport calorique total) à un régime qui apporte 25 pourcent de lipides. Les résultats ont montré que la réduction de l’apport en lipides pendant 6 semaines entraîne une réduction significative dans le taux plasmatique des androgènes(testostérones et androstenedione) ce qui suggère que l’apport en lipides joue un rôle important dans la production des androgènes [14].
Une autre étude clinique publiée dans American journal of clinical nutrition a exploré l’effet de l’adoption d’un régime alimentaire riche en lipides saturé (41 pour cent de l’apport calorique total) et pauvre en fibres à un régime alimentaire faible en lipides (de sources d’acides gras polyinsaturés (18 pour cent de l’apport calorique total) et riche en fibres sur les taux plasmatique de testostérone et sa protéine de transport SHBG (Sex hormone Binding globuline). Les résultats ont montré que le groupe qui a consommé le régime riche en lipides possède une élévation dans le taux plasmatique de testostérone de 13 pourcent et une élévation dans le taux de SHBG de 18 pourcent [15].
La commission européenne de la médecine préventive recommande un apport de 30 à 35 pour cent de lipides par rapport à l’apport calorique total. Pour un régime de 3000 Kcal c’est l’équivalent de 1000 Kcal issu de lipides. ( 100 à 120 g de lipides par jour). L’apport en lipides doit être contenir :
- Les acides gras polyinsaturés oméga 3 (noix, huile d’olives, amandes, poissons).
- Les acides gras saturés (lait, beurre, œuf, graisse animale issue de ruminants nourris à l’herbe).
- Acide gras monoinsaturés oméga 9 (huile d’olive, huile de lin, huile d’amande, huile d’avocat, huile de cacao).
3-5. Assurez un apport adéquat de vitamine D :
La vitamine D est une hormone produite à partir du 7 déhydrocholestérol dans la peau suite à l’exposition des rayonnements ultraviolet de soleil, cette hormone est fabriquée dans le foie suite aux réactions d’hydroxylation pour former le 25 hydroxy-vitamine D (calcidiol) qui va être transporté vers les reins pour former l’alpha,25 dehydroxyvitamine D (calcitriol). Cette forme active de vitamine D peut influencer plus que 900 gènes par voie paracrine. Des données récentes dans la littérature ont montré que la réduction de l’exposition au soleil entraîne une déficience grave dans la production vitamine D. Il a été démontré que la baisse des niveaux sérique de vitamine D et des niveaux élevés de PTH (hormone parathyroïdienne) chez les adultes est associée avec une réduction de la masse et la puissance musculaire [16].
En plus, la liaison de la vitamine D aux récepteurs membranaires (VDR) au niveau des muscles entraîne une activation des voies de signalisations qui aboutissent à la libération du calcium dans le cytosol qui est nécessaire pour la contraction musculaire et la synthèse des protéines [17].
Une étude rétrospective publiée dans le journal de clinical endocrinology qui porte sur 600 adultes a montré que les participants qui ont des niveaux de 25 hydroxy-vitamine D < 50 nm présentent une réduction significative dans la puissance musculaire des jambes. Les auteurs ont conclu que le niveau de vitamine D constitue un facteur important pour le maintien de la force et la masse musculaire [18].
Comment avoir un apport optimal de vitamine D ? :
30 minutes d’exposition directe au soleil entre 11 heures et 15 heures est conseillées pour optimiser la production de vitamine D.
- La consommation des aliments riches en vitamine D3 (cholécalciférol) est conseillé : Œufs issus d’élevage naturel, poissons gras (Saumon, maquereaux, Herring), l’huile de foie de morue, lait et yaourts fortifiés.
- Les aliments riches en vitamine D2 : les champignons de paris.
3-6. Adoptez un régime alimentaire anti-inflammatoire :
La manière la plus efficace pour combattre l’inflammation, c’est d’adopter un régime anti-inflammatoire. Tout simplement éviter les aliments inflammatoires et privilégier les aliments anti-inflammatoires. Une étude publiée dans le journal de Aging a exploré l’effet de l’index inflammatoire de régime alimentaire sur le risque de développement de sarcopénie. Les chercheurs ont constaté que l’augmentation de l’index inflammatoire des aliments d’une unité entraîne une augmentation de 12 pourcent du risque de développement de la sarcopénie [19].
Aliments inflammatoires à éviter :
- Les aliments riches en oméga 6 : les huiles hydrogénées, la margarine , les huiles végétales : de palme , de colza , de canola , de maïs Certains de ces huiles comme l’huile de palme peut augmenter le passage des LPS (lipopolysacharides de l’intestin vers le sang ce qui engendre une inflammation et une hyperperméabilité intestinale.
Note : Les oméga 6 sont des acides gras polyinsaturés indispensables à notre organisme , mais ils sont aujourd’hui consommés en excès par rapport aux oméga 3.
“Parmi les acides gras oméga 6, on retrouve l’acide linoléique, un précurseur de l’acide arachidonique qu’on sait pro-inflammatoire “.
- Glucides raffinés, comme le pain blanc et les pâtisseries ; céréales à gluten.
- Aliments ultra-transformés.
- Frites et autres aliments cuit en fritures.
- Boissons gazeuses et autres boissons sucrées.
- Viande transformée (hot dogs, saucisses et salami).
- Viandes issues d’élevage non naturel, rempli d’antibiotiques et des hormones.
Il a été démontré que le régime alimentaire contenant en abondance ces aliments contribue à l’élévation dans le taux de cytokines inflammatoires (Tumor necrosis factor alpha (TNF-α), interleukin-6 (IL-6) et la protéine C réactive- (CRP) [20].
Cette inflammation pathologique augmente le risque de développement de la sarcopénie à l’âge adulte.
Les aliments anti-inflammatoires à privilégier :
- L’huile d’olive.
- Le miel.
- Les légumes à feuilles vertes, comme les épinards et le chou frisé.
- Les noix comme les amandes et les noisettes.
- Les poissons gras comme le saumon, le maquereau, le thon et les sardines ; les poissons (sauvages, pas d’élevage).
- Les fruits comme les fraises, les bleuets, les cerises, les oranges et les pommes.
- Les épices anti-inflammatoires : comme le curcuma et le romarin.le gingembre, la cannelle
- La farine de petit épeautre, châtaigne, maïs, sarrasin, seigle, pois chiches, blé ancestrale (Kamut), riz.
- Les légumineuses avec modération : Haricot vert, pois chiche et petit pois.
3-7. Des compléments alimentaires et aliments fonctionnels bénéfiques :
- La monohydrate de créatine est un composé produit d’une façon endogène par le foie et les reins à partir de 3 acides aminés, la glycine l’arginine et la méthionine. La créatine intervient dans la synthèse de phosphocréatine qui est un précurseur de synthèse de l’ATP dans le muscle squelettique. Cette molécule est impliquée dans la rétention de l’eau dans le muscle squelettique, ce qui augmente le poids et le volume musculaire. Il a été démontré que la supplémentation avec la créatine permet l’augmentation de la transcription des gènes impliquée dans la synthèse des muscles, la réparation cellulaire [21]. Cette molécule permet aussi l’activation de la protéine Mtor (Mécanistic target of rapamycin) impliquée dans la synthèse du muscle à l’échelle intracellulaire.
Une étude clinique randomisée publiée dans le journal de gérontologie qui porte sur 28 hommes et femmes âgées plus que 65 ans montre que la supplémentation avec la créatine (5 g et 7 g) associé à un exercice physique de résistance musculaire entraîne une augmentation significative de la masse maigre musculaire et une augmentation de la puissance musculaire mesurée par l’exercice d’extension de la jambe [22].
La supplémentation à court terme avec la créatine (5 à 10 g / jour pendant 2 semaines) associée à un programme de résistance musculaire est recommandé chez les adultes pour améliorer les performances physiques [23].
- Les molécules anti-âges :
Il a été démontré que certaines molécules qui se trouvent dans les plantes : resvératrol (contenu dans les raisins rouge), quercitrine (pommes et oignons), epigallocatechin-3-gallate (continu dans le thé) permettent d’activer des voies de signalisation qui favorisent l’activation de la balance redox (sirtuines), l’activation de la biogenèse mitochondriale (PGC1 alpha), l’activation de l’utilisation cellulaire de glucose (AMPK). Toutes ces voies contribuent à l’anabolisme musculaire et inhibent sa destruction. Plus d’études cliniques dans ce sens doivent être mises en place pour évaluer le potentiel de ces molécules contre la sarcopénie.
- Symbiotiques :
Plusieurs études ont montré que l’équilibre de notre microbiote intestinal joue un rôle important dans la biodisponibilité et l’assimilation des nutriments ingéré (vitamines et sels minéraux, acides aminés et acides gras essentiels). Ce qui permet de booster le fonctionnement du système immunitaire et musculaire [24].
La combinaison de probiotiques(bactéries bénéfiques) et de prébiotiques (fibres alimentaires qui fournissent une source d’énergie pour notre microbiote et constituent un substrat sélectif pour les différentes bactéries) constitue une approche efficace pour optimiser l’homéostasie de notre microbiote. Ces bactéries vont métaboliser ces prébiotiques pour fabriquer des post biotiques : des acides gras à chaîne courte qui favorisent la stabilité et l’intégrité de la barrière intestinale.
Les meilleures sources de probiotiques (aliments fermentés : Miso, choucroute, kemchi, Kombucha, légumes lactofermentés).
Les meilleures sources de prébiotiques (fruits et légume, miel, les fructooligosides (l’orge, la chicorée, l’ail, l’asperge, l’oignon ou l’artichaut), galactooligosacharides(haricots, pois, pois chiche, légumes secs, tubercules), disacharides (lactose, produits laitiers), inuline (chicorée, l’agave, l’ail, l’asperge) et cellulose (végétaux verts).
- Les aliments riches en Nitrates :
Les aliments riches en nitrates constituent une approche efficace pour soutenir la croissance musculaire. Les aliments riches en NO3 permettent de booster le niveau d’oxyde nitrique qui assure une fonction endothéliale optimale qui permet de favoriser la circulation sanguine nécessaire pour la distribution des nutriments, les aliments riches en NO3 permettent d’améliorer le fonctionnement mitochondrial durant l’exercice [25].
Les aliments riches en nitrates : (betterave, céleri, radis, épinard et laitu).
Références :
[1] https://www.webmd.com/healthy-aging/guide/sarcopenia-with-aging.
[2] Melton LJ 3rd, Khosla S, Crowson CS, O’Connor MK, O’Fallon WM, Riggs BL. Epidemiology of sarcopenia. J Am Geriatr Soc. 2000 Jun;48(6):625-30. PMID: 10855597.
[3] Evans WJ, Campbell WW. Sarcopenia and age-related changes in body composition and functional capacity. J Nutr. 1993;123:465–468.
[4] Marcell, T. J. (2003). Review Article: Sarcopenia: Causes, Consequences, and Preventions. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 58(10), M911–M916. doi:10.1093/gerona/58.10.m911.
[5] Naseeb, M. A., & Volpe, S. L. (2017). Protein and exercise in the prevention of sarcopenia and aging. Nutrition Research, 40, 1–20. doi:10.1016/j.nutres.2017.01.001.
[6] Kim H, Suzuki T, Saito K, Yoshida H, Kojima N, Kim M, et al. Effects of exercise and tea catechins on muscle mass, strength and walking ability in community-dwelling elderly Japanese sarcopenic women: a randomized controlled trial. Geriatr Gerontol Int 2013;13:458-65.
[7] Deutz NE, Bauer JM, Barazzoni R, Biolo G, Boirie Y, Bosy-Westphal A, Cederholm T, Cruz-Jentoft A, Krznariç Z, Nair KS, Singer P, Teta D, Tipton K, Calder PC. Protein intake and exercise for optimal muscle function with aging: recommendations from the ESPEN Expert Group. Clin Nutr. 2014 Dec;33(6):929-36. doi: 10.1016/j.clnu.2014.04.007. Epub 2014 Apr 24. PMID: 24814383; PMCID: PMC4208946.
[8] Paddon-Jones, Douglas, and Blake B Rasmussen. “Dietary protein recommendations and the prevention of sarcopenia.” Current opinion in clinical nutrition and metabolic care vol. 12,1 (2009): 86-90. doi:10.1097/MCO.0b013e32831cef8b.
[9] Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am J Clin Nutr. 2011 Feb;93(2):402-12. doi: 10.3945/ajcn.110.005611. Epub 2010 Dec 15. PMID: 21159787; PMCID: PMC3021432.
[10] Smith GI, Julliand S, Reeds DN, Sinacore DR, Klein S, Mittendorfer B. Fish oil-derived n-3 PUFA therapy increases muscle mass and function in healthy older adults. Am J Clin Nutr. 2015 Jul;102(1):115-22. doi: 10.3945/ajcn.114.105833. Epub 2015 May 20. PMID: 25994567; PMCID: PMC4480667.
[11] Dupont J, Dedeyne L, Dalle S, Koppo K, Gielen E. The role of omega-3 in the prevention and treatment of sarcopenia. Aging Clin Exp Res. 2019;31(6):825-836. doi:10.1007/s40520-019-01146-1.
[12] Da Boit M, Sibson R, Sivasubramaniam S, et al. Sex differences in the effect of fish-oil supplementation on the adaptive response to resistance exercise training in older people: a randomized controlled trial. Am J Clin Nutr. 2017;105:151–158. doi: 10.3945/ajcn.116.140780.
[12] Gromadzka-Ostrowska J. Effects of dietary fat on androgen secretion and metabolism. Reprod Biol. 2006;6 Suppl 2:13-20. PMID: 17220937.
[13] Hämäläinen E, Adlercreutz H, Puska P, Pietinen P. Diet and serum sex hormones in healthy men. J Steroid Biochem. 1984 Jan;20(1):459-64. doi: 10.1016/0022-4731(84)90254-1. PMID: 6538617.
[14] Hämäläinen E, Adlercreutz H, Puska P, Pietinen P. Diet and serum sex hormones in healthy men. J Steroid Biochem. 1984 Jan;20(1):459-64. doi: 10.1016/0022-4731(84)90254-1. PMID: 6538617.
[15] J F Dorgan, J T Judd, C Longcope, C Brown, A Schatzkin, B A Clevidence, W S Campbell, P P Nair, C Franz, L Kahle, P R Taylor, Effects of dietary fat and fiber on plasma and urine androgens and estrogens in men: a controlled feeding study, The American Journal of Clinical Nutrition, Volume 64, Issue 6, December 1996, Pages 850–855, https://doi.org/10.1093/ajcn/64.6.850.
[16] Visser M, Deeg DJ, Lips P. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam. J Clin Endocrinol Metab. 2003;88:5766–72.
[17] Montero-Odasso M, Duque G. Vitamin D in the aging musculoskeletal system: an authentic strength preserving hormone. Mol Aspects Med. 2005;26:203–19.
[18] Scott D, Blizzard L, Fell J, Ding C, Winzenberg T, Jones G. A prospective study of the associations between 25-hydroxy-vitamin D, sarcopenia progression and physical activity in older adults. Clin Endocrinol (Oxf) 2010;73:581–7.
[19] Geng, Jiwen et al. “Dietary inflammatory potential and risk of sarcopenia: data from national health and nutrition examination surveys.” Aging vol. 13,2 (2020): 1913-1928. doi:10.18632/aging.202141.
[20] Tabung FK, Steck SE, Zhang J, Ma Y, Liese AD, Agalliu I, Hingle M, Hou L, Hurley TG, Jiao L, Martin LW, Millen AE, Park HL, et al.. Construct validation of the dietary inflammatory index among postmenopausal women. Ann Epidemiol. 2015; 25:398–405. 10.1016/j.annepidem.2015.03.009.
[21] Safdar A, Yardley NJ, Snow R, Melov S, Tarnopolsky MA. Global and targeted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation. Physiol Genomics. 2008;32:219–28.
[22] Brose A, Parise G, Tarnopolsky MA. Creatine supplementation enhances isometric strength and body composition improvements following strength exercise training in older adults. J Gerontol A Biol Sci Med Sci. 2003 Jan;58(1):11-9. doi: 10.1093/gerona/58.1.b11. PMID: 12560406.
[23] Morley JE, Argiles JM, Evans WJ, Bhasin S, Cella D, Deutz NE, et al. Nutritional recommendations for the management of sarcopenia. J Am Med Dir Assoc. 2010;11:391.
[24] Tiihonen K, Ouwehand AC, Rautonen N. Human intestinal microbiota and healthy ageing. Ageing Res Rev. 2010;9:107–16.
[25] Larsen FJ, Weitzberg E, Lundberg JO, Ekblom B. Dietary nitrate reduces maximal oxygen consumption while maintaining work performance in maximal exercise. Free Radic Biol Med. 2010;48:342–7.